- Departamento de Neurocirugía, Hospital Italiano de Buenos Aires, Peron, CABA, Argentina
Correspondence Address:
Santiago Hem
Departamento de Neurocirugía, Hospital Italiano de Buenos Aires, Peron, CABA, Argentina
DOI:10.4103/sni.sni_288_18
Copyright: © 2019 Surgical Neurology International This is an open access journal, and articles are distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 License, which allows others to remix, tweak, and build upon the work non-commercially, as long as appropriate credit is given and the new creations are licensed under the identical terms.How to cite this article: Santiago Hem, Sofía Beltrame, Jorge Rasmussen, Eduardo Vecchi, Federico Landriel, Claudio Yampolsky. Utilidad de la cirugía espinal mínimamente invasiva en el manejo de las metástasis espinales toraco-lumbares. 15-Feb-2019;10:
How to cite this URL: Santiago Hem, Sofía Beltrame, Jorge Rasmussen, Eduardo Vecchi, Federico Landriel, Claudio Yampolsky. Utilidad de la cirugía espinal mínimamente invasiva en el manejo de las metástasis espinales toraco-lumbares. 15-Feb-2019;10:. Available from: http://surgicalneurologyint.com/surgicalint-articles/usefulness-of-minimally-invasive-spine-surgery-for-the-management-of-thoracolumbar-spinal-metastases/
Abstract
Objetivo:Describir los resultados quirúrgicos y evolución de pacientes con metástasis espinales toraco-lumbares operadas con técnica mínimamente invasiva (MISS) utilizando para la decisión terapéutica la evaluación: Neurológica, Oncológica, Mecánica y Sistémica (NOMS).
Material y Métodos:Se incluyeron en forma prospectiva pacientes con metástasis espinales toraco-lumbares operados con técnica MISS por el Servicio de Neurocirugía del Hospital Italiano de Buenos Aires entre Junio de 2014 y Junio de 2017. Se utilizó en todos los casos el algoritmo de evaluación NOMS para la decisión terapéutica. Se analizaron los resultados quirúrgicos postoperatorios como el Karnofsky performance status, dolor (VAS – visual analog scale), Frankel, pérdida sanguínea, necesidad de transfusiones, complicaciones, uso de opioides y días de internación. Se consideró como estadísticamente significativo una P
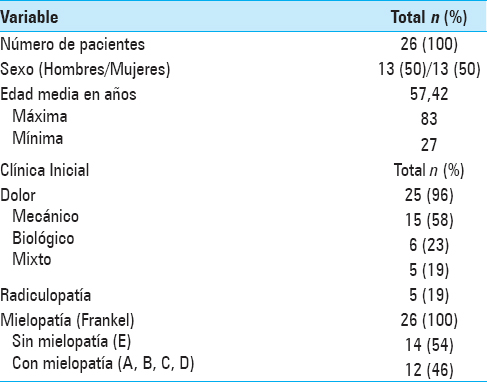
Resultados:Durante el período de estudio 26 pacientes cumplieron los criterios de inclusión, de los cuales 13 fueron mujeres. La edad promedio fue 57 (27-83) años. El origen más frecuente de las lesiones fue cáncer de mama (27%). El síntoma más constante fue el dolor (96%), aunque 12 pacientes manifestaron inicialmente mielopatía (46%). Se observaron grados avanzados de invasión del canal con requerimiento de descompresión en el 65% de los casos. Acorde al Spinal Instability Neoplastic Score, 23 pacientes (89%) presentaron lesiones potencialmente inestables o inestables, requiriendo estabilización. Se evidenció una mejoría estadísticamente significativa del VAS en el 77% y del Frankel en el 67% de los casos tras la cirugía. No hubo necesidad de transfusiones. Se registró sólo una complicación quirúrgica leve (4%). La media de internación fue de 5.5 días.
Conclusión:En nuestra serie y utilizando como algoritmo terapéutico el NOMS, la cirugía MISS resultó efectiva tanto para la descompresión como para la estabilización espinal, con baja tasa de complicaciones y rápida recuperación postoperatoria.
Keywords: Minimally invasive surgery, spinal cord compression, spinal instability, spinal metastasis, Compresión medular, cirugía mínimamente invasiva, inestabilidad espinal, metástasis espinales
INTRODUCCIÓN
La columna vertebral es el tercer sitio más frecuente donde metastatizan las células cancerígenas, luego del pulmón y el hígado. Por ello, las metástasis espinales constituyen una complicación frecuente en pacientes con enfermedad oncológica sistémica, alcanzando una incidencia de 30%–70%.[
En la mayoría de los casos, el tratamiento de las metástasis espinales no tiene un objetivo curativo, siendo la principal herramienta terapéutica la radioterapia, ya sea convencional o radiocirugía según la biología tumoral, seguido por el resto de armamento oncológico (quimioterapia, hormonoterapia, anticuerpos monoclonales).[
Está demostrado que la cirugía puede aliviar los síntomas y mejorar la calidad de vida de estos pacientes.[
En los últimos años existen cada vez más trabajos sobre los amplios beneficios de la cirugía espinal mínimamente invasiva (MISS) en el tratamiento de las patologías de la columna vertebral. Entre las ventajas más reportadas se encuentran la reducción del trauma muscular, de la pérdida hemática intraoperatoria, del dolor postoperatorio, menor costo global y menor estadía intrahospitalaria con pronta recuperación.[
En el año 2013, fue publicado el marco de trabajo para el manejo de metástasis espinales NOMS,[
En resumen, el marco NOMS, mediante la consideración de la clínica neurológica, el grado de invasión epidural, la inestabilidad espinal en conjunto con la radiosensibilidad del tumor y la reserva sistémica del paciente propone un algoritmo terapéutico para una óptima combinación de la modalidad radiante y quirúrgica según cada caso.
El objetivo de nuestro trabajo es describir los resultados quirúrgicos y evolución de pacientes con metástasis espinales toraco-lumbares operadas con técnica mínimamente invasiva utilizando para la decisión terapéutica la evaluación NOMS (Neurológica; Oncológica; Mecánica; Sistémica).
MATERIAL Y MÉTODOS
Se estudiaron en forma prospectiva pacientes operados de metástasis espinales toraco-lumbares con técnica MISS en el Hospital Italiano de Buenos Aires entre Junio de 2014 y Junio de 2017. Todos los casos fueron presentados y discutidos en ateneos interdisciplinarios y se utilizó para la toma de decisión terapéutica el algoritmo de trabajo NOMS.[
Todos los pacientes fueron evaluados con Resonancia Magnética (RM) de columna completa, radiografías de columna frente, perfil y en flexo-extensión según el segmento afectado, Tomografía Computada de tórax, abdomen y pelvis, así como también con otros estudios diagnósticos necesarios para la estadificación oncológica según el caso (mamografía, centellograma óseo corporal total, tomografía por emisión de positrones (PET TC), etc.).
Se analizaron datos epidemiológicos como edad, sexo y datos clínicos al momento de la consulta (tipo de dolor, signos y síntomas de mielopatía o radiculopatía). Se evaluaron 4 puntos de cada paciente según el marco de trabajo NOMS para la decisión terapéutica. La evaluación del estado neurológico (N) se basó en la clínica y en la observación de la secuencia T2 axial de la Resonancia Magnética en el sitio de mayor compromiso, analizando el grado de compresión medular según el sistema de 6 grados propuesto en el NOMS: Epidural Spinal Cord Compression: ESCC.[
0: lesión confinada al cuerpo vertebral sin invasión del espacio epidural. 1: invasión del espacio epidural
a: no deforma el saco dural b: deforma el saco dural c: contacta con la médula, pero no la comprime 2: compresión medular con visualización de LCR 3: compresión medular sin visualización de LCR.
Acorde a este protocolo, aquellos pacientes con grados de compresión 1c, 2 y 3 fueron candidatos para descompresión de la médula espinal. Como segundo punto se consideró el aspecto oncológico (O), evaluándose el tipo histológico de tumor primario y su respuesta a los distintos tratamientos oncológicos, principalmente la radioterapia convencional o radiocirugía.[
La escala de Karnofky (KPS), el VAS y el uso de opioides para el alivio sintomático fueron evaluados en el preoperatorio y los 7 días. El KPS se agrupo por rangos: 10%–40%; 50%–70%; 80%–100%. El dolor a su vez, se clasificó según el principal mecanismo involucrado en su génesis, como: mecánico, local o biológico y radicular.[
Fueron excluidos aquellos pacientes con déficit neurológico completo Frankel A de más de 24 hs de evolución; pacientes tratados con cirugía convencional abierta o radioterapia; pacientes con compresión medular secundaria a tumores altamente radiosensibles (mieloma, seminoma y linfoma), lesiones que no presentaban inestabilidad (SINS menor a 7); pacientes con pronóstico de vida menor a 3 meses a los cuales se realizaron cuidados paliativos y pacientes en quienes se realizó cementación percutánea como única intervención. Además, se excluyeron aquellos casos con pérdida en el seguimiento.
El análisis estadístico fue realizado con el Software STATA versión 14. Para las variables cuantitativas continuas se utilizó la media aritmética como medida resumen de los datos y el desvío estándar como medida de dispersión. Para la comparación de variables categóricas se utilizó el Test Chi Cuadrado. Se consideró una P estadísticamente significativa aquella menor a 0.05.
CASOS ILUSTRATIVOS
Caso 1
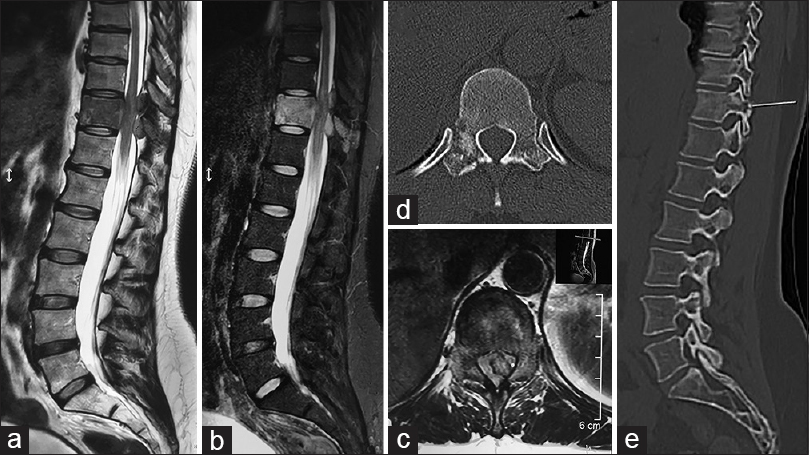
Mujer de 43 años de edad con antecedente de cáncer neuroendócrino de cuello uterino tratado mediante histerectomía total, quimioterapia y radioterapia pelviana. Consulta a nuestra institución por debilidad de miembros inferiores de 48 hs. de evolución. Al examen físico presenta paraparesia 4/5, hipoestesia en ambos miembros inferiores, hiperreflexia y Babinski bilateral (Frankel D, KPS 50). Además, presentaba dolor dorso-lumbar permanente (VAS 6/10), incluso nocturno, que empeoraba con la bipedestación (VAS 9/10) de 20 días de evolución sin respuesta a AINEs y con altos requerimientos de opioides. Se realizaron estudios por imágenes para diagnóstico y estadificación. En la RM se constató lesión infiltrativa a nivel del cuerpo, pedículos y espinosa de T11 con invasión del canal espinal y compresión medular [Figura
Figura 1
Imágenes preoperatorias de caso 1. a y b: Evidencian la lesión tumoral a nivel T11 en cortes sagitales de RMN en secuencias T2 y STIR respectivamente. c: Muestra un corte axial en secuencia T2, donde se constata la invasión completa del canal. d y e: Imágenes de TAC que demuestran la invasión osea de la metástasis
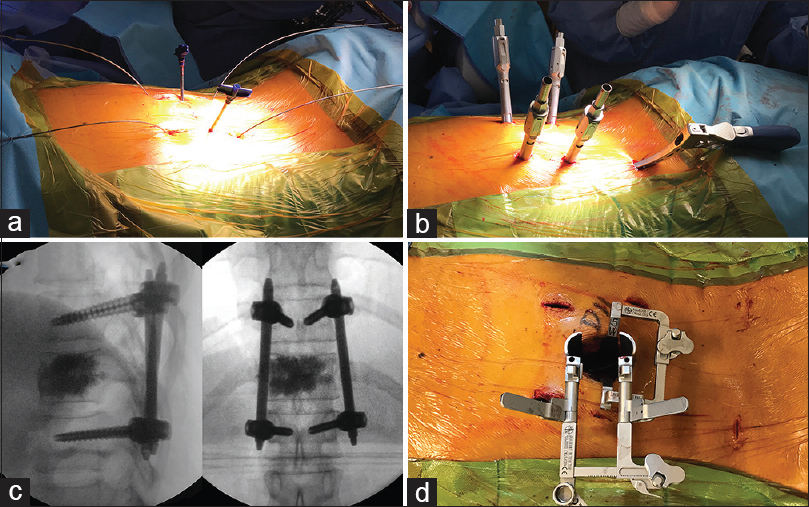
Figura 2
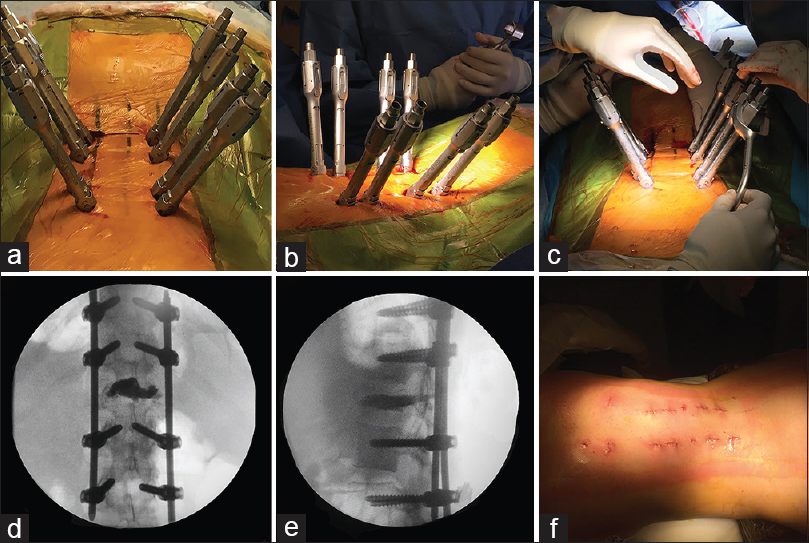
Imágenes intraoperatorias de caso 1. a: Muestra los alambres guía en los pedículos a instrumentar y las cánulas para cementación bipedicular. b: Evidencia las torres de los tornillos percutáneos y el pasa-barra percutáneo. c: Control con radioscopia AP y lateral. d: Muestra el separador tubular retráctil a través del cual se realizó la descompresión MISS
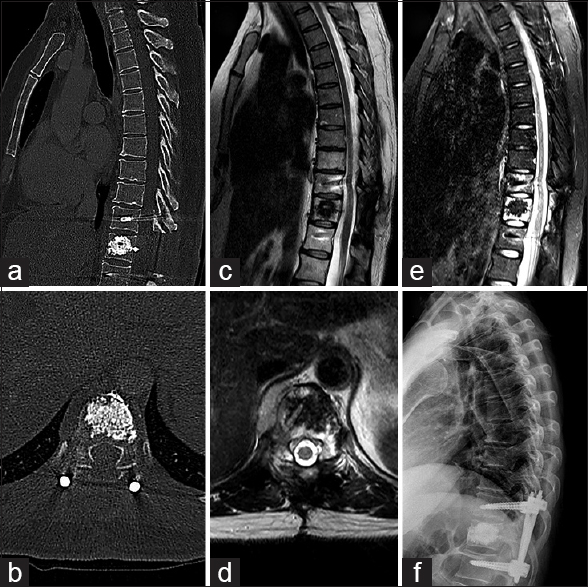
Figura 3
Imágenes postquirúrgicas de caso 1. a y b: Muestran la descompresión segmentaria y cementación en cortes sagitales y axiales tomográficos c y e. Muestran adecuada descompresión en RMN control cortes sagitales T2 y STIR respectivamente. d: Evidencia buena liberación en un corte axial secuencia de RMN T2 a los 3 meses de la intervención. f: Imagen radiográfica de control a los 12 meses
Caso 2
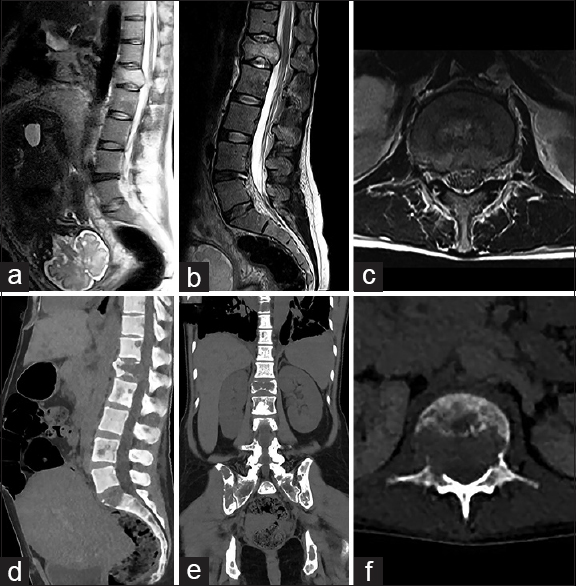
Mujer de 37 años con antecedente de diagnóstico de cáncer de mama (intraductal infiltrante hormono-dependiente) a los 26 años, tratada con cuadrantectomía más vaciamiento ganglionar, quimio y radioterapia. Diez años más tarde, durante el tercer trimestre de su segundo embarazo, comienza con dolor lumbar progresivo. Al momento de la consulta se constató lumbalgia severa permanente con exacerbación máxima ante la bipedestación, pero sin ningún tipo de déficit neurológico. (Frankel E, KPS 80, VAS 10/10). Se solicitó RM y TAC de urgencia donde se observaron múltiples lesiones metastásicas a lo largo de toda la columna vertebral siendo el compromiso de L1 el de mayor relevancia clínico-quirúrgica [Figura
Figura 4
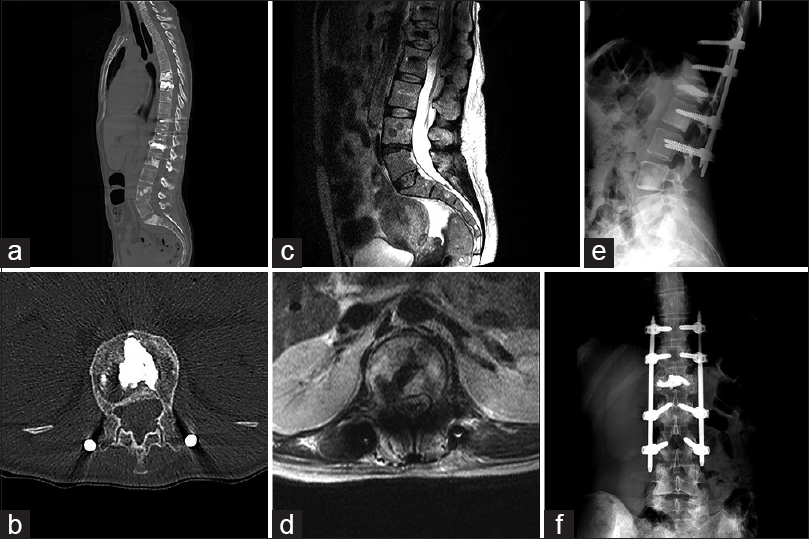
Imágenes preoperatorias de caso 2. a: Evidencia útero grávido en RMN. b: Muestra la lesión tumoral a nivel L1 en un corte sagital de RMN en secuencias T2. c: Demuestra un corte axial en secuencia T2, donde se constata la invasión del canal. d-f: Imágenes de TAC que demuestran la invasión osea de la metástasis en L1, lesiones multicéntricas espinales y en hígado
Figura 5
Imágenes intraoperatorias de caso 2. a y b: Evidencian la alineación y convergencia de las torres de los tornillos percutáneos. c: Muestra la marcación para la colocación de la barra percutánea. d y e: Control con radioscopia AP y lateral. f: Muestra las incisiones cutáneas para la instrumentación MISS
RESULTADOS
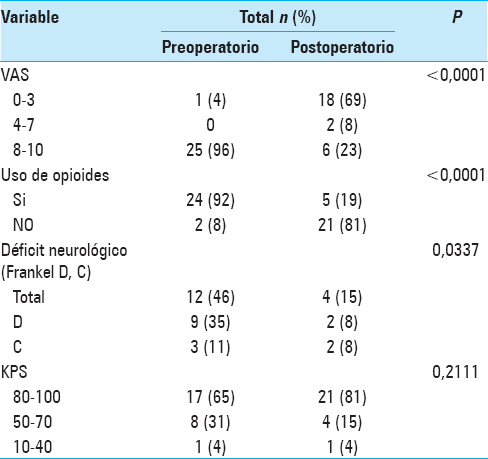
El total de pacientes que reunieron los criterios de inclusión fueron 26, de los cuales el 50% (n = 13) correspondieron al sexo femenino. La edad media fue de 57 ± 12.8 años (rango 27–83). El mínimo período de seguimiento postoperatorio fue de 3 meses. El dolor fue el síntoma principal al momento de la consulta, presente en 96% de los pacientes, de éstos el 58% (n = 15) presentaron dolor de tipo mecánico, el 23% (n = 6) dolor de tipo biológico y en 5 casos dolor mixto (19%). Además del dolor, el 19% (n = 5) de los pacientes de la serie refirieron síntomas de radiculopatía y el 46% (n = 12) se presentaron con mielopatía en distintos grados como signo-sintomatología inicial [
Al examen neurológico, de los 12 pacientes con síntomas de mielopatía un 75% (n = 9) fueron Frankel D y un 25% (n = 3) fueron Frankel C. Con respecto al grado de compresión medular (ESCC) se constató que el 8% (n = 2) de los pacientes presentaron un grado 1a, el 27% (n = 7) grado 1b, el 19% (n = 5) grado 1c, el 19% grado 2 (n = 5), y el 27% (n = 7) grado 3 [
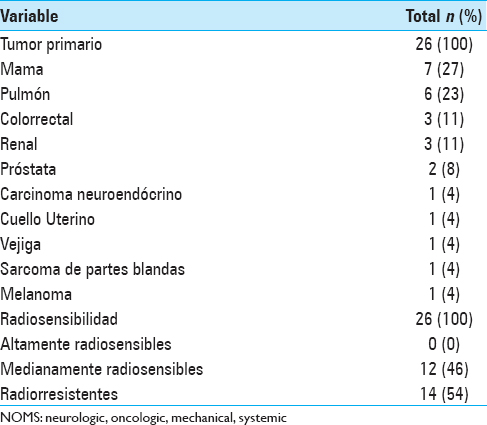
En cuanto al tumor primario, el más frecuente fue cáncer de mama que representó el origen del 27% (n = 7) de los casos, le siguió el cáncer de pulmón con un 23% (n = 6), luego el cáncer colorrectal con un 11% (n = 3), el cáncer de riñón 11% (n = 3), próstata 8% (n = 2), cuello uterino 4% (n = 1), carcinoma neuroendócrino de cuello uterino 4% (n = 1), melanoma 4% (n = 1), vejiga 4% (n = 1), y un sarcoma de partes blandas 4% (n = 1). De estos tumores, el 46% (n = 12) fueron considerados como tumores radiosensibles y el 54% (n = 14) tumores radiorresistentes [
Con respecto a la localización, el 77% (n = 20) de los pacientes presentaron metástasis torácicas y el 23% (n = 6) metástasis lumbares. El sitio más común fue la columna semirrígida de T3 a T10 con un 54% (n = 14), seguido por los sitios de transición toracolumbar, lumbosacra y columna torácica alta (C7-T2, T11-L1, L5-S1) con un 31% (n = 8), y un 15% (n = 4) en la columna móvil (L2-L4). Según la tomografía computada, la lesión evaluada fue en 11 casos osteolítica (42%), en 6 osteoblástica (23%) y en 9 mixta (35%). En 9 pacientes se observó más del 50% de colapso del cuerpo vertebral (35%), en 13 menos del 50% (50%) y 4 casos sin colapso (15%). En 25 pacientes se constató compromiso de elementos posteriores siendo en un 60% bilateral (n = 15) y en un 40% unilateral (n = 10). Con respecto a la alineación espinal, en 12 casos se observó algún tipo de deformidad de novo como cifosis o escoliosis (46%). Con estos datos, asociados a la clínica del paciente se calculó el SINS resultando éste menor o igual a 6 puntos en el 11% (n = 3) de los casos, entre 7 y 12 en el 58% (n = 15) y mayor o igual a 13 en el 31% (n = 8) de los casos [
El 69% (n = 18) fueron considerados ASA 2 y el 31% (n = 8) ASA 3. Solo 1 paciente se presentó con un KPS de 10%–40% (4%), 8 con un KPS del 50%–70% (31%) y 17 con un KPS del 80-100% (65%). Con respecto al número de vértebras comprometidas 18 pacientes presentaban más de un nivel afectado (69%). El 100% de los pacientes presentaban además metástasis en otros sitios, siendo los sitios más frecuentes de diseminación los ganglios linfáticos, otros huesos y el hígado. Con esta información se calculó el Score de Tokuhashi que resultó de 0 a 8 en el 46% (n = 12) de los pacientes, de 9 a 11 en el 46% y de 12 a 15 en 2 casos [
De los 25 pacientes con alguna forma de dolor, el VAS preoperatorio fue mayor o igual a 8 en todos los casos. Del total de pacientes, el 92% (n = 24) utilizaban opioides además de AINEs para el alivio sintomático. Un 77% (n = 20) de los pacientes mejoraron notoriamente durante el período de seguimiento, 5 pacientes se mantuvieron estables (19%) y 1 caso (4%) empeoró (P < 0,0001). De los 24 (92%) pacientes que utilizaban opioides en el preoperatorio, 5 (19%) continuaron usándolos durante el postoperatorio tardío, por lo que el consumo de morfina y derivados se redujo un 75% (P < 0,0001). De los 12 pacientes que presentaban algún tipo de déficit neurológico, en 8 casos (67%) se observó una mejoría durante el período postoperatorio. De los 9 pacientes que presentaban un Frankel D se observó una mejoría en 7 (78%) de ellos, mientras que de los 3 (33%) pacientes se presentaron con un Frankel C solo uno mejoró (P = 0,0337). El resto de los pacientes mantuvieron estable su Frankel inicial. Del 65% (n = 17) con un KPS inicial de 80-100%, 16 (94%) pacientes lo mantuvieron estable tras la cirugía y un paciente lo empeoró (6%). De los 8 (31%) pacientes con un KPS entre 50%–70%, 5 (63%) lo mejoraron, 3 (37%) lo mantuvieron estable y ninguno empeoró. El único paciente con un KPS de 40 en el preoperatorio, lo mantuvo estable en el postoperatorio (P = 0,2111), ver
La internación media fue de 5.58 días (rango 3–14) y el promedio de pérdida hemática en la cirugía fue de 220 mL (rango 80–330), en ningún caso fueron necesarias transfusiones intra o postoperatorias inmediatas. Con respecto a las complicaciones quirúrgicas, un paciente (4%) presentó una pequeña dehiscencia de herida que completó su curación con puntos de sutura sin requerir una nueva cirugía y no retrasó el inicio de la terapia radiante. Como complicaciones médicas, en un caso se diagnosticó una trombosis venosa del miembro inferior que requirió la colocación de un filtro de vena cava y otro paciente presento una infección del tracto urinario bajo.
Con respecto al tratamiento, el 19% (n = 5) de los pacientes fueron sometidos a descompresión MISS sin fijación, de éstos, en el 8% (n = 2) además se cementó la vértebra sintomática por ser potencialmente inestable y adicionalmente como tratamiento sintomático del dolor. En el 50% (n = 13) de los pacientes se realizó descompresión MISS más fijación percutánea y en el 8% de ellos además se realizó cementación percutánea de la vértebra comprometida. En el 31% (n = 8) de los pacientes únicamente se realizó fijación percutánea sin descompresión, de los cuales 4 (16%) además se cementaron. Aquellos pacientes que se fijaron y cementaron presentaban dolor biológico severo asociado al dolor mecánico por inestabilidad. Todos los pacientes en quienes se realizó únicamente fijación percutánea sin descompresión presentaban inestabilidad con un grado de compresión medular (ESCC) 1a o 1b, excepto en 1 caso con grado 1b pero con radiculopatía funcional (paresia) y dolor severo en quien se realizó una foraminotomía MISS. En todos los casos además del tratamiento quirúrgico, los pacientes recibieron tratamiento adyuvante con radioterapia y/o quimioterapia según las indicaciones del médico especialista y las guías actuales [
DISCUSIÓN
En los últimos años existe una tendencia a un incremento en la incidencia de metástasis espinales como consecuencia del aumento de la expectativa de vida de los pacientes oncológicos. Esto es gracias a los avances en la detección precoz del cáncer y en los tratamientos modernos instaurados.[
El rol de la cirugía espinal en este contexto comprende: prevenir el déficit neurológico progresivo mediante la descompresión de las estructuras neurales (cuando se trata de tumores que no son altamente radiosensibles), la estabilización de la columna espinal para prevenir o corregir la deformidad o la compresión secundaria al colapso vertebral, y aliviar el dolor, permitiendo la movilización precoz del paciente.[
Si bien la cirugía resulta entonces parte del armamento terapéutico de estos pacientes, surge un segundo dilema acerca de qué tipo de intervención es la más apropiada en esta población tan vulnerable, que además de su patología espinal presentan una enfermedad sistémica que compromete habitualmente otros órganos, comorbilidades adicionales como desnutrición, hipercoagulabilidad e inmunosupresión, sumado muchas veces a otras afecciones propias de cada paciente.[
El marco de trabajo NOMS surge como herramienta guía para la toma de decisiones en el manejo terapéutico de pacientes con metástasis espinales, combinando tanto estrategias de tratamiento oncológico (radioterapia o radiocirugía, quimioterapia e inmunoterapia) como quirúrgico. Su aplicación, que integra terapéuticas multimodales, tiene por objetivo optimizar el control local de la enfermedad, aliviar el dolor, restaurar y preservar la función neurológica minimizando la morbilidad en esta frágil población de pacientes.[
Por ello, el marco NOMS, además de la ingeniosa, práctica e integral evaluación que propone, destaca algunas consideraciones muy importantes a la hora de comprender el flujo de las decisiones terapéuticas que plantea. Por un lado, remarca que la radioterapia (convencional o radiocirugía) constituye el tratamiento de elección para el control local de las metástasis de columna, cambiando de alguna manera el histórico objetivo quirúrgico de ’máxima resección’ por ’cirugía de separación’ (lograr separación entre el tumor y la médula), para poder optimizar la dosis de radiación sobre el volumen del tumor sin toxicidad sobre las estructuras nerviosas. Por otro lado, también destaca la importancia de la determinación de la estabilidad espinal mediante el cálculo del SINS, a raíz del cual se puede objetivar la necesidad de algún tipo intervención quirúrgica (cementación – fijación) independientemente de la radiosensibilidad del tumor o del grado de invasión del conducto raquídeo.
Laufer y col.,[
Los avances en cirugía MISS durante los últimos años han logrado alcanzar los mismos objetivos terapéuticos con una reducción de las complicaciones con respecto a la tradicional cirugía abierta que resulta, en ocasiones, muy agresiva en estos pacientes. Las principales ventajas reportadas con abordajes mínimamente invasivos son menor pérdida sanguínea intraoperatoria y por ende menor necesidad de transfusiones, menor dolor y uso de analgésicos postoperatorios, menor cantidad de días de hospitalización, menor tasa de infección y dehiscencia de heridas postquirúrgica, resultados que se asocian a una mejoría precoz en la calidad de vida pero sobre todo que evitan retrasar el inicio del resto del esquema terapéutico onco-específico.[
Se han descripto a los fines prácticos 3 tipos de dolor asociado a las metástasis espinales: dolor mecánico, biológico y radicular; pudiendo coexistir formas mixtas. El dolor mecánico se caracteriza por ser severo, asociado al movimiento que típicamente empeora con la carga cuando el paciente se incorpora y mejora con el reposo en decúbito. Este dolor está asociado a la inestabilidad vertebral y no responde a la medicación anti-inflamatoria, ni a la quimio y/o radioterapia. Requiere de algún tipo de estabilización que restaure total o parcialmente la integridad mecánica espinal perdida. Por otra parte, el dolor local o biológico, es aquel producido por mediadores inflamatorios generados por el crecimiento y la infiltración tumoral. Es permanente, a menudo nocturno, no cambia con el movimiento y presenta moderada respuesta a los AINES, a los corticoesteroides y a la radioterapia. Finalmente, el dolor radicular, es aquel generado producto de la afección de la raíz nerviosa, por lo que sigue típicamente una distribución radicular, y puede presentar en su génesis mecanismos y características de los dos tipos previos de dolor. En nuestros resultados, la gran mayoría de los pacientes mejoraron el VAS en el período postoperatorio. El único caso donde se observó un empeoramiento del VAS tras la cirugía, correspondió a un paciente cuya clínica inicial era de mielopatía sin dolor. Es por ello que en dicho caso, el dolor fue interpretado como postoperatorio y adecuado a la intervención efectuada. En vista de estos resultados la técnica MISS permite tratar en forma efectiva los tres tipos diferentes de dolor, ya sea mediante la descompresión, fijación y/o cementación.
Las ventajas de la cirugía MISS respecto a la cirugía abierta para el manejo de metástasis espinales ha sido puesta a prueba en diferentes trabajos científicos. Miscusi y col. concluyeron que los pacientes operados con técnica MISS presentan una recuperación neurológica y clínica mucho más rápida que los pacientes operados con cirugía abierta gracias a que mejoran rápidamente el VAS postoperatorio, su funcionalidad, con menor requerimiento analgésico; y esto se traduce en un mejor resultado quirúrgico en términos de calidad de vida, lo que es verdaderamente importante en pacientes con baja o intermedia sobrevida.[
Es de destacar que muchos pacientes incluidos en nuestro estudio presentaron Scores de Tokuhashi bajos lo que se traduce en pronósticos de sobrevida medios o cortos, incluso menores a 6 meses.[
CONCLUSIÓN
En nuestra serie y utilizando como algoritmo terapéutico el NOMS, la cirugía MISS resultó efectiva tanto para la descompresión como para la estabilización espinal, con baja tasa de complicaciones y rápida recuperación postoperatoria.
Financial support and sponsorship
Nil.
Conflicts of interest
There are no conflicts of interest.
References
1. Bhatt A, Schuler J, Boakye M, Woo SY. Current and emerging concepts in non-invasive and minimally invasive management of spine metastasis. Cancer Treat Rev. 2013. 39: 142-52
2. Bilsky M, Laufer I, Fourney D, Groff M, Schmidt MH, Varga PP. Reliability analysis of the epidural spinal cord compression scale. J Neurosurg Spine. 2010. 13: 324-8
3. Chaudhary R, Bhaduri D, Bhatia M, Hatti S, Ba R, Meva J. Influence of comorbidity in cancer surgery on treatment decisions, postoperative course and oncological outcome. Asia Pac J Clin Oncol. 2013. 9: 47-52
4. Fisher C, DiPaola C, Ryken T, Bilsky MH, Shaffrey CI, Berven SH. A novel classification system for spinal instability in neoplastic disease: An evidence-based approach and expert consensus from the Spine Oncology Study Group. Spine (Phila Pa 1976). 2010. 35: 1221-9
5. Goodwin CR, Abu-Bonsrah N, Rhines LD, Verllan J-J, Bilsky MH, Laufer I. Molecular markers and targeted therapeuticts in metastatic tumors of spine: Changing the treatment paradigms. Spine (Phila Pa 1976). 2016. 41: S218-23
6. Hansen-Algenstaedt N, Algenstaedt P, Bottcher A, Joscheck C, Schwarzloh B, Schaefer C. Bilaterally increased VEGF levels in muscles during experimental unilateral callus distraction. J Orthop Res. 2003. 21: 805-12
7. Hansen-Algenstaedt N, Kwan M, Algenstaedt P, Chiu CK, Viezens L, Chan TS. Comparison between minimally invasive surgery and conventional open surgery for patients with spinal metástasis. Spine Surgery. 2017. 42: 789-97
8. Harel R, Angelov L. Spine metastases: Current treatments and future directions. Eur J Cancer. 2010. 46: 2696-707
9. Hsieh P, Koski T, Sciubba D, Moller DJ, O’Shaughnessy BA, Li KW. Maximizing the potential of minimally invasive spine surgery in complex spinal disorders. Neurosurg Focus. 2008. 25: E19-
10. Huang T, Hsu R, Li Y, Cheng CC. Minimal access spinal surgery (MASS) in treating thoracic spine metastasis. Spine (Phila Pa 1976). 2006. 31: 1860-3
11. Kan P, Schmidt M. Minimally invasive thoracoscopic approach for anterior decompression and stabilization of metastatic spine disease. Neurosurg Focus. 2008. 25: E8-
12. Kim CW. Scientific basis of minimally invasive spine surgery: prevention of multifidus muscle injury during posterior lumbar surgery. Spine. 2010. 35: 281-6
13. Landriel Ibañez FA, Hem S, Ajler P, Vecchi E, Ciraolo C, Baccanelli M. A new classification of complications in neurosurgery. World Neurosurg. 2011. 75: 709-15
14. Laufer I, Rubin D, Lis E, Stubblefield MD, Yamada Y, Bilsky MH. The NOMS framework: Approach to the treatment of spinal metastatic tumors. Oncologist. 2013. 18: 744-51
15. Logroscino C, Proietti L, Tamburrelli F. Minimally inva-sive spine stabilisation with long implants. Eur Spine J. 2009. 18: 75-81
16. Scusi M, Polli F, Forcato S, Ricciardi L, Frati A, Cimatti M. Comparison of minimally invasive surgery with standard open surgery for vertebral thorasic metastases causing acute mielopathy in patients with short or mid term life expectancy: Surgical technique and early clinical results. J Neurosurg Spine. 2015. 22: 518-25
17. Mobbs R, Sivabalan P, Li J. Technique, challenges and indications for percutaneous pedicle screw fixation. J Clin Neurosci. 2011. 18: 741-9
18. Ouoglu O. Minimally invasive management of spinal metastases. Orthop Clin North Am. 2009. 40: 155-68
19. Ouraishi N, Manoharan S, Arealis G, Khurana A, Elsayed S, Edwards KL. Accuracy of the revised Tokuhashi score in predicting survival in patients with metastatic spinal cord compression (MSCC). Eur Spine J. 2013. 22: S21-6
20. Parks S, Lee C, Chung S, Lee K. How accurately can tokuhashi score system predict survival in the current practice for spinal metastases: Prospective analysis of 145 consecutive patients between 2007 and 2013. J Spinal Disord Tech. 2015. 28: E219-24
21. Pascal-Moussellard H, Broc G, Pointillart V, Siméon F, Vital JM, Sénégas J. Complications of vertebral metastasis surgery. Eur Spine J. 1998. 7: 438-44
22. Patchell R, Tibbs P, Regine W, Payne R, Saris S, Kryscio RJ. Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: A randomised trial. Lanc. 2005. 366: 643-8
23. Schaefer C, Fuhrhop I, Schroeder M, Viezens L, Otten J, Fiedler W. Microcirculation of secondary bone tumors in vivo: The impact of minor surgery at a distal site. J Orthop Res. 2010. 28: 1515-21
24. Schaefer C, Schroeder M, Fuhrhop I, Viezens L, Otten J, Fiedler W. Primary tumor dependent inhibition of tumor growth, angiogenesis, and perfusion of secondary breast cancer in bone. J Orthop Res. 2011. 29: 1251-8
25. Sciubba D, Petteys R, Dekutoski M, Fisher CG, Fehlings MG, Ondra SL. Diagnosis and management of metastatic spine disease. A review. J Neurosurg Spine. 2010. 13: 94-108
26. Tokuhashi Y, Matsuzaki H, Oda H, Oshima M, Ryu J. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis. Spine. 2005. 30: 2186-91
27. Wang M, Cummock M, Yu Y, Trivedi RA. An analysis of the differences in the acute hospitalization charges following minimally invasive versus open posterior lumbar interbody fusion. J Neurosurg Spine. 2010. 12: 694-9
28. Weber M, Burch S, Buckley J, Schmidt MH, Fehlings MG, Vrionis FD. Instability and impending instability of the thoracolumbar spine in patients with spinal metastases: A systematic review. Int J Oncol. 2011. 38: 5-12
29. Weigel B, Maghsudi M, Neumann C, Kretschmer R, Müller FJ, Nerlich M. Surgical management of symptomatic spinal metastases. Postoperative outcome and quality of life. Spine (Phila Pa 1976). 1999. 24: 2240-6
30. Zairi F, Marinho P, Allaoui M, Assaker R. New advances in the management of thoracolumbar spine metastasis. Bull Cancer. 2013. 100: 435-41










Jesus Farinas Yanes
Posted December 17, 2020, 12:30 am
Gran estudio que cumple con los estándares internacionales, con el uso de escalas de medición para diagnostico y tratamiento de los tumores que atacan la columna vertebral, los felicito.