- Fetal Medicine Unit, Hospital Universitario Austral, Pilar, Buenos Aires, Argentina
- Department of Neurosurgery, Hospital Universitario Austral, Pilar, Buenos Aires, Argentina
- Department of Paediatric Surgery, Hospital Universitario Austral, Pilar, Buenos Aires, Argentina
- Department of Obstetrics, Hospital Universitario Austral, Pilar, Buenos Aires, Argentina
- Department of Anesthesiology, Hospital Universitario Austral, Pilar, Buenos Aires, Argentina
- Department of Neonatology, Hospital Universitario Austral, Pilar, Buenos Aires, Argentina
Correspondence Address:
Adolfo Etchegaray
Department of Paediatric Surgery, Hospital Universitario Austral, Pilar, Buenos Aires, Argentina
DOI:10.4103/sni.sni_236_18
Copyright: © 2018 Surgical Neurology International This is an open access journal, and articles are distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 License, which allows others to remix, tweak, and build upon the work non-commercially, as long as appropriate credit is given and the new creations are licensed under the identical terms.How to cite this article: Adolfo Etchegaray, Fernando Palma, Roberto De Rosa, Ricardo Daniel Russo, Ernesto Beruti, Rodolfo Fregonese, Hernán Allegrotti, Gabriel Musante, Angeles Cibert, Florencia Contino Storz, Sofia Marchionatti. Cirugía fetal de mielomeningocele: Evolución obstétrica y resultados perinatales a corto plazo de una cohorte de 21 casos. 26-Nov-2018;9:
How to cite this URL: Adolfo Etchegaray, Fernando Palma, Roberto De Rosa, Ricardo Daniel Russo, Ernesto Beruti, Rodolfo Fregonese, Hernán Allegrotti, Gabriel Musante, Angeles Cibert, Florencia Contino Storz, Sofia Marchionatti. Cirugía fetal de mielomeningocele: Evolución obstétrica y resultados perinatales a corto plazo de una cohorte de 21 casos. 26-Nov-2018;9:. Available from: http://surgicalneurologyint.com/surgicalint-articles/9075/
Abstract
Objetivo:Describir la técnica quirúrgica, evolución obstétrica y resultados perinatales de una cohorte de pacientes sometidas a cirugía intrauterina para reparación de una disrafia fetal abierta (DFA).
Métodos:Análisis prospectivo de 21 casos consecutivos de DFA con diagnóstico y tratamiento quirúrgico prenatal en nuestra institución entre 2015 y 2017. La técnica de la cirugía fetal (QF) fue similar a la descripta en el estudio MOMS, excepto que se utilizó histerotomía con asa bipolar. Los cuidados postoperatorios, nacimiento y cuidados neonatales se realizaron en la misma institución. Se analizaron complicaciones perioperatorias de la QF, la evolución obstétrica y los resultados perinatales.
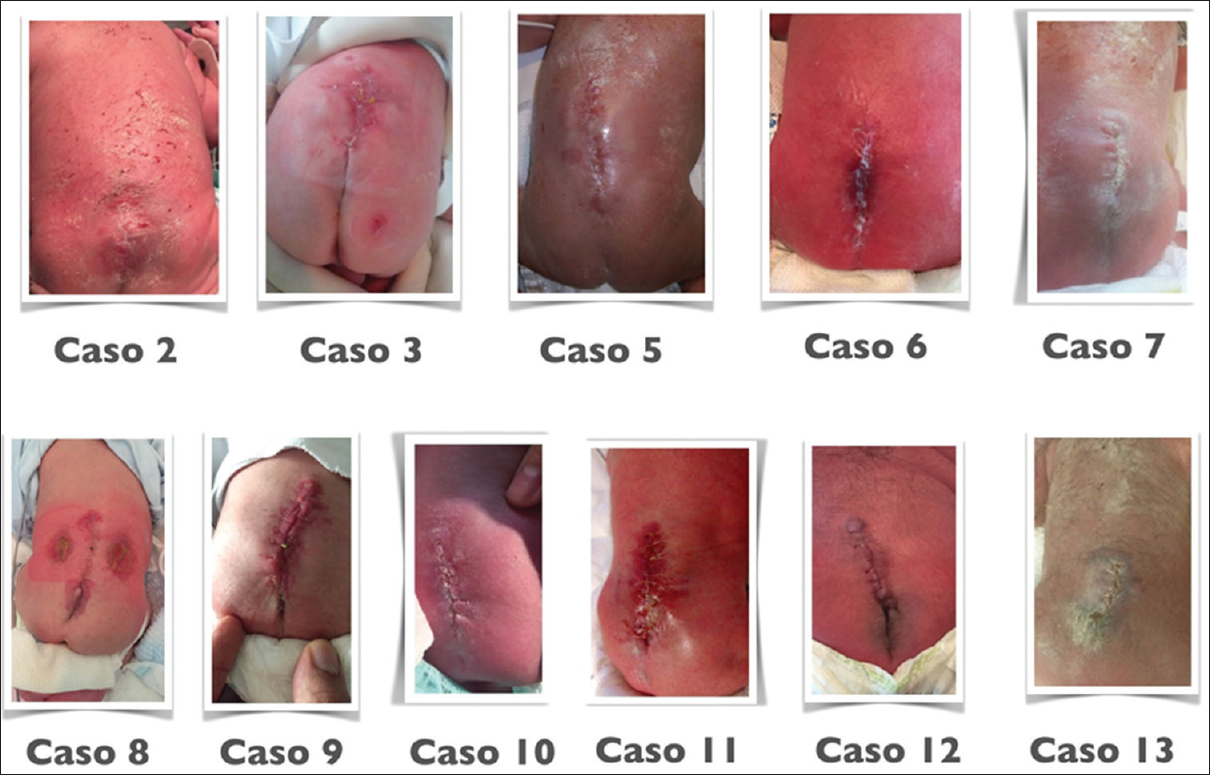
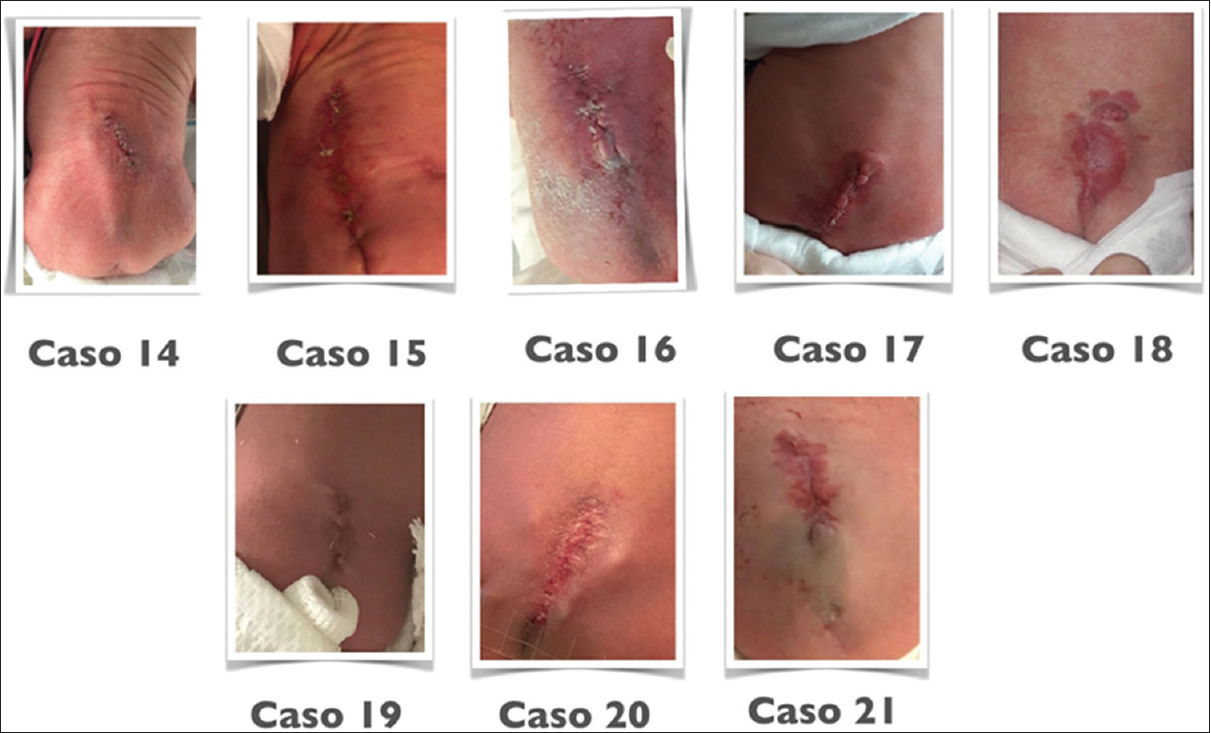
Resultados:La QF se realizó a una edad gestacional media de 25.8 semanas (24.1-27.6). La edad gestacional media al nacer fue 34.2 semanas (29.2-37.1). El tiempo quirúrgico medio fue 138 min (101-187) con tendencia descendente y el tiempo de internación medio, 7.1 días (4-32). El 52% (11/21) de las pacientes experimentó rotura prematura de membranas (RPM). Ninguna paciente requirió transfusiones postcesárea. No hubo casos de desprendimiento placentario, rotura uterina ni muertes maternas. La cicatrización de la histerorafia fue normal en 95% de las pacientes. La sobrevida perinatal fue del 95% (20/21, una muerte intrauterina secundaria a banda amniótica). La necesidad de cierre cutáneo postnatal (CCP) fue del 5%. Ninguno de los casos (20) reparados con tejidos fetales requirió CCP. El 70% (14/20) de los pacientes no requirió ningún tratamiento para hidrocefalia. Cuatro pacientes (20%) requirieron una derivación ventriculoperitoneal (DVP) y dos adicionales, una tercer ventriculostomía endoscópica (ETV) (10%). El nivel funcional motor neonatal (NFN) fue mejor que el nivel anatómico prenatal (NAP) en 45% (9/20), igual en 50% (10/20) y peor en 5% (1/20).
Conclusiones:El presente estudio confirma que la cirugía fetal de disrafias abiertas se asocia a un mayor riesgo de parto prematuro y rotura prematura de membranas, pero reduce significativamente la necesidad de tratamiento postnatal de hidrocefalia y mejora la función motora a corto plazo. Nuestros resultados son similares a los publicados en el ensayo aleatorizado MOMS.
Keywords: Fetal surgery, spina bifida, myelomeningocele, open spinal dysraphism, Cirugía fetal, mielomeningocele
INTRODUCCIÓN
Los defectos del tubo neural (DTN) son un grupo importante de anomalías congénitas graves que se asocian con una alta morbimortalidad perinatal, así como grados considerables de discapacidad a largo plazo, con los consiguientes costos emocionales, psicológicos y económicos.[
Dentro de este grupo, la espina bífida (y su variedad más común, el mielomeningocele, MMC) tiene en nuestro país una prevalencia estable cercana a 1 en 2000 recién nacidos.[
A pesar de que la suplementación periconcepcional de las harinas con ácido fólico (Ley No 25.630 de julio de 2002) ha reducido significativamente su prevalencia en la primera década de este siglo,[
Según datos oficiales, esta patología se encuentra dentro de las 10 primeras causas de mortalidad neonatal[
Aunque en los últimos años se han descripto técnicas mini-invasivas para el tratamiento de la hidrocefalia, tales como la tercerventriculostomía endoscópica (ETV) y la cauterización del plexo coroideo (CPC), éstas no han demostrado ser particularmente efectivas en el lactante con mielomeningocele, por lo que la derivación ventriculoperitoneal (DVP), con todos sus problemas asociados (infección, disfunción valvular, etc.) siguen siendo la base del tratamiento.
Estudios a largo plazo muestran que, para los 30 años, la mayoría de los casos más gravemente afectados han fallecido, siendo los principales predictores de morbimortalidad el déficit neurológico en la infancia y el antecedente de DVP.[
Los primeros casos de reparación de espina bífida en el útero se realizaron en 1994 utilizando un acceso endoscópico.[
Los sesgos inherentes a la evaluación de los resultados de la cirugía fetal en comparación con los controles históricos llevaron a que se diseñara un ensayo aleatorizado en febrero de 2003 para responder a esta controversia.
El estudio controlado aleatorizado MOMS realizado en 3 centros de EEUU y publicado en febrero de 2011,[
Luego de realizar un entrenamiento intensivo en modelos animales en centros de Europa y Estados Unidos entre los años 2010 y 2014, el Programa de Cirugía Fetal del Hospital Universitario Austral, comenzó a ofrecer esta intervención a un grupo seleccionado de pacientes con disrafias espinales abiertas desde marzo de 2015.
El objetivo de este estudio es describir la técnica quirúrgica, lq evolución obstétrica, y los resultados perinatales de una cohorte de pacientes sometidas a cirugía intrauterina para reparación de una disrafia fetal abierta.
MATERIAL Y MÉTODOS
Diseño
Se trata de un estudio de cohorte prospectivo conformado por 21 casos consecutivos de fetos con disrafias espinales abiertas con diagnóstico, cirugía intrauterina, seguimiento postoperatorio y postnatal en nuestro centro, entre marzo de 2015 y diciembre de 2017.
Criterios de elegibilidad
Utilizamos una versión ampliada de los criterios de elegibilidad descriptos en el estudio MOMS, basándonos en que una cohorte histórica propia de 32 fetos con disrafias fetales (datos no publicados), revelaba que un 32% de las mujeres tenía como contraindicación una cesárea anterior y un 40% de los casos eran derivados después de las 25 semanas (ventana terapéutica MOMS). La ampliación de los criterios de elegibilidad permitió incluir un 46% adicional de casos.
Adicionalmente, estudios recientes sugieren que la realización de la cirugía antes de las 24 semanas se asocia a un riesgo significativamente mayor de separación corioamniótica,[
Criterios de inclusión
Embarazo simple Edad gestacional 24.0 a 27.6 semanas Nivel vertebral entre T1-S1. Evidencia de malformación de Chiari II en la resonancia fetal Cariotipo/QF-PCR normal Edad materna mayor o igual a 18 años Capacidad de alojarse cerca del hospital entre la cirugía y el nacimiento.
Criterios de exclusión
Defectos estructurales mayores no relacionados con la disrafia Cifosis severa Riesgo aumentado de parto prematuro Índice de masa corporal >40 Historia de desprendimiento de placenta Antecedente de más de una cesárea anterior o una cesárea previa con período inter-genésico menor a 18 meses.
Técnica quirúrgica
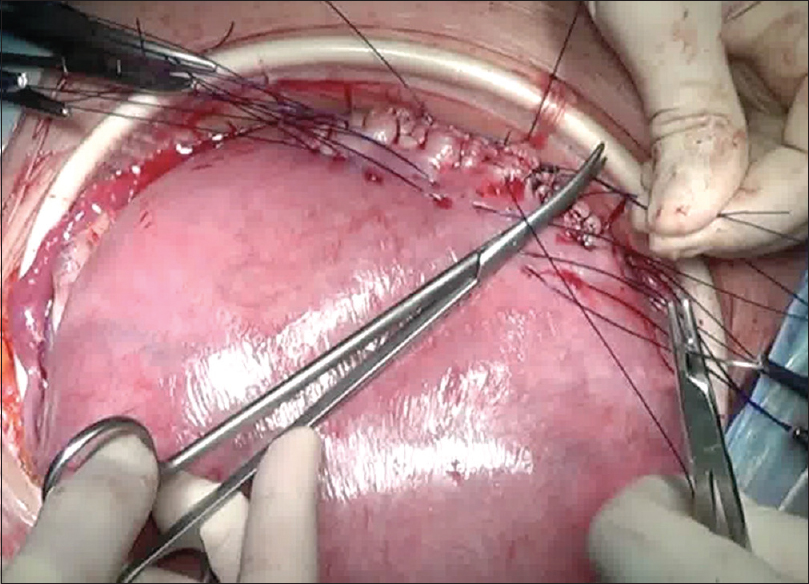
El equipo quirúrgico está conformado por un anestesista entrenado en anestesia maternofetal, un obstetra especialista en medicina fetal, un cirujano pediátrico/fetal, un neurocirujano infantil, el obstetra de cabecera, dos instrumentadoras entrenadas y personal médico de apoyo en quirófano.
Utilizamos anestesia mixta (general y peridural), con la intención de lograr por un lado un mejor control del tono uterino y perfusión placentaria intraoperatoria, y al mismo tiempo una adecuada analgesia en el postoperatorio.
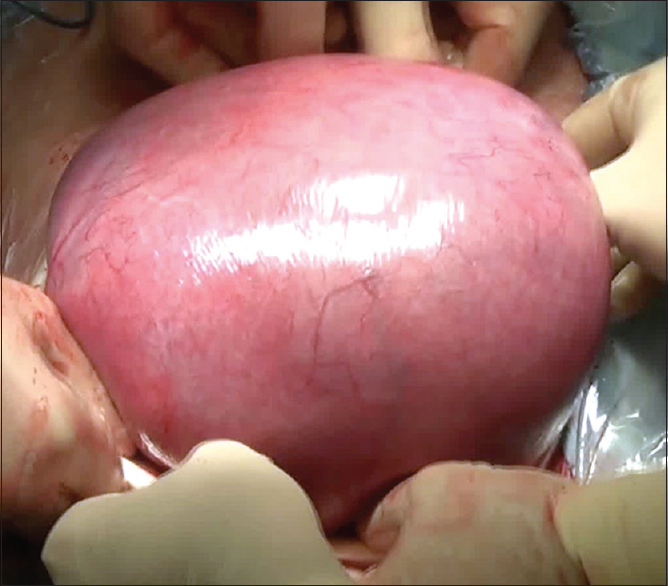
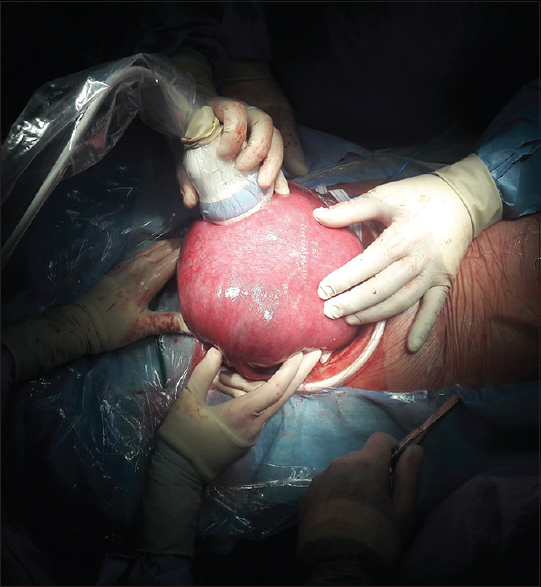
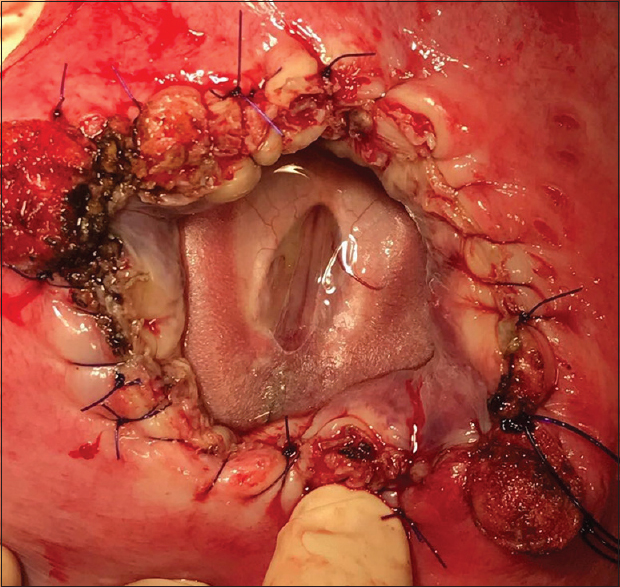
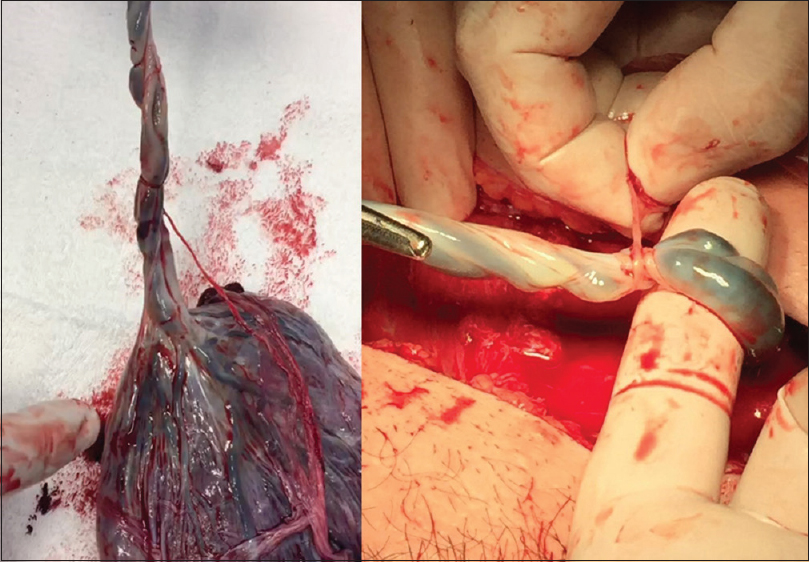
Luego de una ecografía preoperatoria para determinar localización placentaria y establecer las dosis anestésicas para el feto, se realiza una incisión tipo Pfannenstiel ampliada con disección de los planos hasta exponer el útero [
El especialista en medicina fetal localiza la espalda del feto e inyecta un cocktail anestésico (compuesto por vecuronio, fentanilo y atropina) en uno de los glúteos con posterior control de la frecuencia cardíaca [
En resumen, la técnica quirúrgica es similar a la descripta en el ensayo MOMS, a excepción de:
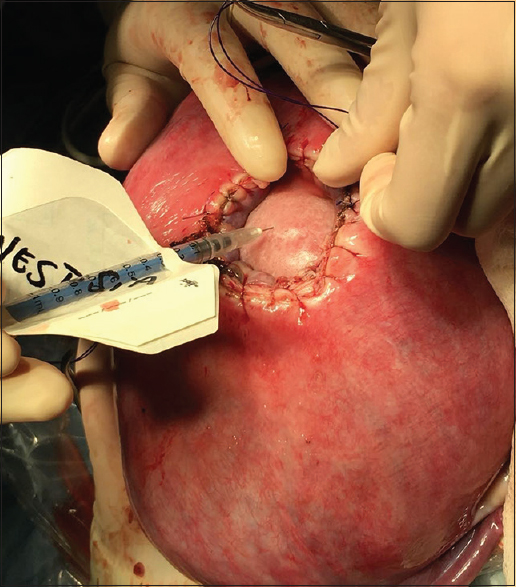
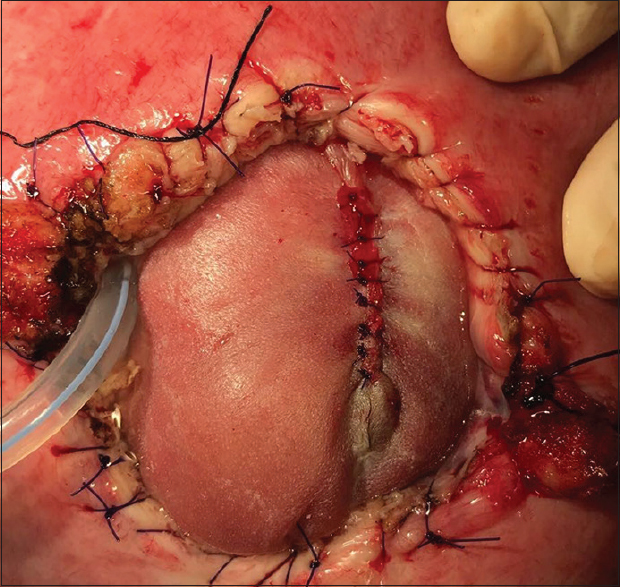
Apertura uterina con asa bipolar a partir del segundo caso Dosis única de sulfato de magnesio intraquirúrgica (neuroprotección fetal) Uso de Atosiban además de indometacina y nifedipina como agentes tocolíticos Histerorrafia en 3 planos.
Después de la cirugía y la recuperación anestésica, la paciente pasa a una terapia intermedia obstétrica con enfermeras entrenadas en manejo del postoperatorio de cirugía fetal.
Luego del alta se realizan controles ecográficos semanales, una resonancia postquirúrgica al mes y controles obstétricos cada dos semanas. En aquellas pacientes sin rotura prematura de membrana o trabajo de parto espontáneo, se realiza cesárea programada con inspección dirigida de la histerorrafia a las 37 semanas.
El seguimiento postoperatorio, nacimiento y cuidados neonatales se realizaron en la misma institución. No hubo pérdidas de datos en el seguimiento de los pacientes.
Variables analizadas
Se analizaron las siguientes variables:
Maternas
Edad gestacional de cirugía Muerte materna o complicaciones postoperatorias severas Tiempo quirúrgico Tiempo de internación Rotura prematura de membranas (RPM) Corioamnionitis.
Perinatales
Sobrevida perinatal Edad gestacional al nacer Necesidad de cierre cutáneo postnatal (CCP) Necesidad de tratamiento de la hidrocefalia con DVP o ETV Evolución de la herniación romboencefálica (por resonancia fetal pre y postquirúrgica) Diferencia entre el nivel motor anatómico prenatal (por ecografía y resonancia magnética) y nivel motor funcional neonatal (clínico).
RESULTADOS
La cirugía fetal se realizó en una edad gestacional media de 25.8 semanas (24–27.6 semanas de gestación).
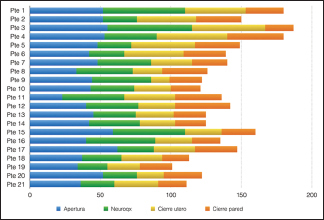
El tiempo quirúrgico medio fue de 138 minutos (rango: 101–187 min) con tendencia descendente, dependiente de la curva de aprendizaje [
El tiempo medio de internación materna fue 7.1 días (rango: 4–32).
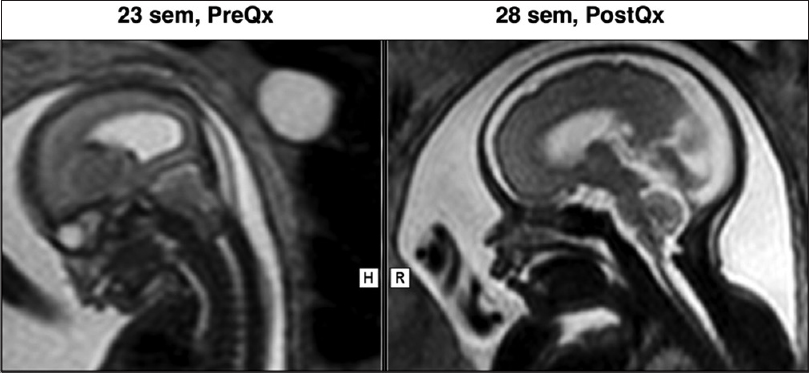
La sobrevida perinatal fue del 95% (20/21). Hubo una muerte fetal secundaria a una banda amniótica en el cordón umbilical a los 60 días de la cirugía (semana 34 de gestación) [
La edad gestacional media al nacer fue de 34.2 semanas (rango: 29.2–37.1). No hubo ninguna muerte materna ni complicaciones obstétricas severas, como desprendimiento de placenta o rotura uterina. El 52% (11/21) de las pacientes experimentó rotura prematura de membrana a una edad gestacional media de 30.6 sem. (26.6–35.0). Una paciente tuvo corioamnionitis (4.7%).
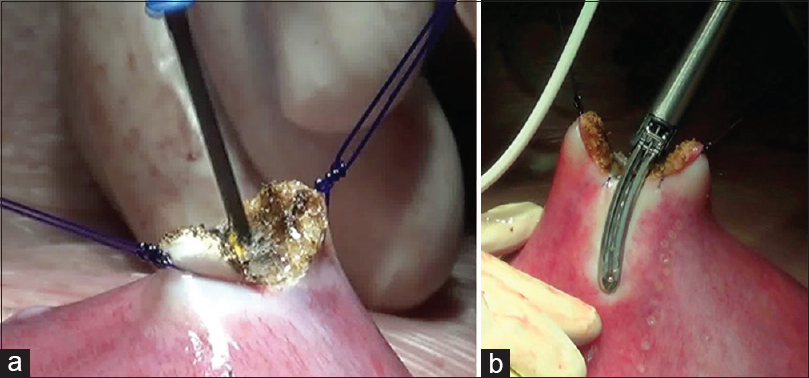
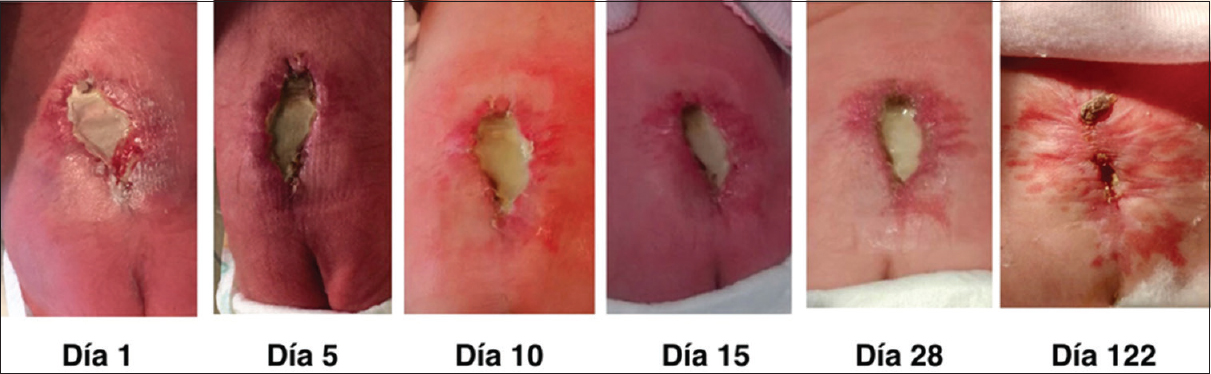
La necesidad de cierre cutáneo postnatal fue de 5% (1/20) (primer caso, en el que se colocó parche sintético cutáneo que tuvo que ser removido) [
La mejoría o resolución prenatal de la herniación romboencefálica fue del 95% (20/21) [
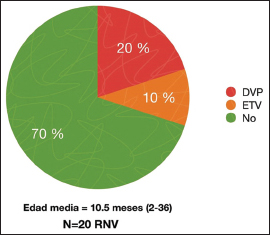
El 70% (15/20) de los pacientes no requirió ningún tratamiento para la hidrocefalia,
4 pacientes requirieron DVP (20%) y 2 ETV (10%) [
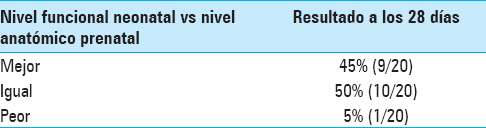
El nivel funcional motor neonatal (evaluado a los 28 días) fue mejor que el nivel anatómico prenatal en 45% de los casos (9/20; 1 nivel: 30%, 2 niveles: 5%, 3 niveles: 5%, 4 niveles: 4%), igual en 50% de los casos (10/20), y peor en 5% (1/20) [
DISCUSIÓN
La cirugía fetal requiere del esfuerzo coordinado de muchos especialistas, incluidos los cirujanos pediátricos, neurocirujanos, especialistas en medicina materno-fetal, obstetras, imagenólogos con experiencia en resonancia fetal, neonatólogos, anestesiólogos, genetistas, enfermeras, trabajadores sociales y psicólogos.[
Los recursos necesarios para comenzar un programa de cirugía fetal no deben subes-timarse. Se requiere de un equipo multidisciplinario con experiencia para evaluar a los pacientes, llevar a cabo los procedimientos y realizar el seguimiento postquirúrgico. El equipo y las instalaciones requeridas son costosos, y resultan difíciles de justificar si se va a realizar un número muy pequeño de estos procedimientos, lo cual complica además la adquisición y mantenimiento de las destrezas quirúrgicas necesarias, con lo que la paciente “paga” la curva de aprendizaje del equipo. No está claro aún qué porcentaje de los nuevos centros sin experiencia en este procedimiento podrán replicar los resultados del ensayo MOMS.
En los últimos años, ha crecido el interés en lograr un acceso uterino menos invasivo para la madre mediante cirugía fetoscópica.[
Es importante recordar que la cirugía prenatal no constituye una “cura” para la espina bífida, pero no obstante esta alternativa terapéutica temprana ha superado los rigores de un ensayo clínico diseñado correctamente y confiere un claro beneficio a mediano plazo para fetos seleccionados adecuadamente. Sigue existiendo una pregunta legítima: para una condición grave no letal, ¿qué tan importantes son estas mejoras en la calidad de vida, en comparación con el riesgo y el costo de la cirugía fetal? Para el obstetra, que no suele ocuparse del cuidado y seguimiento del paciente con mielomeningocele durante la infancia y la edad adulta, la relación riesgo-beneficio puede parecer cuestionable. Para el neurocirujano, urólogo, ortopedista, padre o paciente, las mejoras significativas en la deambulación y los beneficios derivados de evitar las complicaciones asociadas al tratamiento de la hidrocefalia proporcionadas por la cirugía fetal, pueden ser de enorme importancia. Estudios futuros proporcionarán datos sobre calidad de vida a largo plazo y análisis de costo-beneficio que ayuden a responder estas preguntas.
Mientras tanto, es esencial que los especialistas que atienden al feto comuniquen los beneficios y riesgos potenciales de la cirugía fetal de una manera honesta y equilibrada, para que los padres puedan tomar una decisión autónoma e informada.
CONCLUSIÓN
El presente estudio confirma que la cirugía intrauterina de disrafias fetales abiertas se asocia a un mayor riesgo de parto prematuro y rotura prematura de membranas, pero reduce significativamente la necesidad de tratamiento postnatal de hidrocefalia y mejora la función motora a corto plazo. Nuestros resultados se encuentran en línea con los del estudio MOMS, ofreciendo en nuestro medio una alternativa al tratamiento convencional neonatal, con resultados neurológicos significativamente superiores para el recién nacido afectado.
Financial support and sponsorship
Nil.
Conflicts of interest
There are no conflicts of interest.
References
1. Adzick NS, Sutton LN, Crombleholme TM, Flake AW. Successful fetal surgery for spina bifida. Lancet. 1998. 352: 1675-6
2. Adzick NS, Thom EA, Spong CY, Brock JW, Burrows PK, Johnson MP. A randomized trial of prenatal versus postnatal repair of myelomeningocele. N Engl J Med. 2011. 364: 993-1004
3. Belfort MA, Whitehead WE, Shamshirsaz AA, Ruano R, Cass DL, Olutoye OO. Fetoscopic repair of meningomyelocele. Obstet Gynecol. 2015. 126: 881-4
4. Belfort MA, Whitehead WE, Shamshirsaz AA, Bateni ZH, Olutoye OO, Olutoye OA. Fetoscopic open neural tube defect repair: Development and refinement of a two-port, carbon dioxide insufflation technique. Obstet Gynecol. 2017. 129: 734-43
5. Bidondo María P, Liascovich R, Barbero P, Groisman B. Prevalence of neural tube defects and estimation of cases averted in the post-fortification period in Argentina. Archivos argentinos de pediatria. 2015. 113: 498-501
6. Botto LD, Moore CA, Khoury MJ, Erickson JD. Neural-tube defects. N Engl J Med. 1999. 341: 1509-19
7. Bowman RM, McLone DG, Grant JA, Tomita T, Ito JA. Spina bifida outcome: A 25-year prospective. Pediatric Neurosurg. 2001. 34: 114-20
8. Bruner JP, Tulipan NE, Richards WO. Endoscopic coverage of fetal open myelomeningocele in utero. Am J Obstet Gynecol. 1997. 176: 256-7
9. Bruner JP, Tulipan N, Paschall RL, Boehm FH, Walsh WF, Silva SR. Fetal surgery for myelomeningocele and the incidence of shunt-dependent hydrocephalus. JAMA. 1999. 282: 1819-25
10. Cohen AR, Couto J, Cummings JJ, Johnson A, Joseph G, Kaufman BA. Position statement on fetal myelomeningocele repair. Am J Obstet Gynecol. 2014. 210: 107-11
11. Last accessed on 2018 Apr 24. Available from: http://www.deis.gov.ar .
12. Flake A. Percutaneous minimal-access fetoscopic surgery for myelomeningocele –Not so minimal!. Ultrasound Obstet Gynecol. 2014. 44: 499-500
13. Graf K, Kohl T, Neubauer BA, Dey F, Faas D, Wanis FA. Percutaneous minimally invasive fetoscopic surgery for Spina Bifida aperta. Part III: Neurosurgical intervention in the first postnatal year. Ultrasound Obstet Gynecol. 2016. 47: 158-61
14. Grosse Scott D, Ouyang L, Collins JS, Green D, Dean JH, Stevenson RE. Economic evaluation of a neural tube defect recurrence-prevention program. Am J Prev Med. 2008. 35: 572-7
15. Kabagambe SK, Jensen GW, Chen YJ, Vanover MA, Farmer DL. Fetal surgery for myelomeningocele: A systematic review and meta-analysis of outcomes in fetoscopic versus open repair. Fetal Diagn Ther. 2018. 43: 161-74
16. Oakeshott P, Hunt GM. Long-term outcome in open spina bifida. Br J Gen Pract. 2003. 53: 632-6
17. Ouyang L, Grosse SD, Armour BS, Waitzman NJ. Health care expenditures of children and adults with spina bifida in a privately insured U.S. population. Birth Defects Res A Clin Mol Teratol. 2007. 79: 552-8
18. Pedreira DA, Nelci Zanon L, Nishikuni K, Moreira de SáRA, Acacio GL, Chmait RH. Endoscopic surgery for the antenatal treatment of myelomeningocele: The CECAM trial. Am J Obstet Gynecol. 2016. 214: 111.e1-11
19. Last accessed on 2018 Apr 24. Available from http://www.msal.gov.ar/congenitas/material-equipos-de-salud/ .
20. Rintoul NE, Sutton LN, Hubbard AM, Cohen B, Melchionni J, Pasquariello PS. Anew look at myelomeningoceles: Functional level, vertebral level, shunting, and the implications for fetal intervention. Pediatrics. 2002. 109: 409-13
21. Soni S, Moldenhauer JS, Spinner SS, Rendon N, Khalek N, Martinez-Poyer J. Chorioamniotic membrane separation and preterm premature rupture of membranes complicating in utero myelomeningocele repair. Am J Obstet Gynecol. 2016. 214: 647.e1-7
22. Sutton LN, Adzick NS, Bilaniuk LT, Johnson MP, Crombleholme TM, Flake AW. Improvement in hindbrain herniation demonstrated by serial fetal magnetic resonance imaging following fetal surgery for myelomeningocele. JAMA. 1999. 282: 1826-31
23. Tulipan N, Bruner JP. Myelomeningocele repair in utero: A report of three cases. Pediatr Neurosurg. 1998. 28: 177-80
24. Wong LY, Paulozzi LJ. Survival of infants with spina bifida: A population study 1979-94. Paediatr Perinat Epidemiol. 2001. 15: 374-8
25. Yi Y, Lindemann M, Colligs A, Snowball C. Economic burden of neural tube defects and impact of prevention with folic acid: A literature review. Eur J Pediatr. 2011. 170: 1391-400
Commentary
Comentario
Graciela Zuccaro- Sanatorio Trinidad Palermo, CABA, Buenos Aires, Argentina
Los autores presentan una importante casuística para nuestro medio de 21 casos de fetos con mielomeningocele (MMC), cuya corrección se efectuó intraútero. La cuidadosa descripción de la técnica que utilizaron y las magníficas fotos que presentan revelan que se trata de un equipo multidisciplinario bien entrenado, nada improvisado, y con sobrada experiencia cada uno en lo suyo (obstetras, neurocirujanos, anestesistas, etc.).
Antes de continuar con el comentario de esta presentación, y con autorización del Dr. Socolovsky me he permitido resumir la historia y estado actual de la cirugía fetal, que tantos dilemas éticos y religiosos ha suscitado.
Cuando en el año 2000 comenzamos a trabajar en cirugía fetal en CEMIC bajo la dirección del propio Michael Harrison, que vino a pasar su año sabático a Buenos Aires para entrenarnos y ayudarnos en las primeras cirugías fetales que realizamos, nos planteamos tres preguntas:
¿Por qué la cirugía fetal? ¿Es realmente el feto un paciente? ¿Por qué la neurocirugía fetal es importante en Latinoamérica?
¿Por qué la cirugía fetal?: Hasta los finales del siglo XX se creía que el MMC era exclusivamente el resultado de la no-neurulación que ocurre al final del primer mes de gestación en la región lumbosacra. Pero Patten, en 1053,[ Así surgió “two-hit pathogenesis”: el hit primario es la no-neurulación y el hit secundario es el daño adquirido en útero. Como sobre el primer hit no podemos actuar todavía, si podríamos actuar sobre el segundo. Así nació la Cirugía Fetal. Esto motivó a los investigadores a reproducir en animales (ovejas, monos, conejos, cerdos) defectos del tubo neural, y comparar grupos de animales reconstruidos en útero con los que nacían sin haber sido reparados. Estos últimos nacían parapléjicos e incontinentes a diferencia de los reparados que nacían con normal motilidad y vejiga continente. Michael Harrison, cirujano infantil de UCSF (Universidad de San Francisco), fue el primero en operar un feto en útero realizando una vesicostomía a cielo abierto, en 1981, y describió y practicó otras técnicas de Cirugía Infantil. Pero el primer MMC operado intraútero por fetoscopía fue realizado por Bruner y Tulipan, a través de fetoscopía en 1997 con muy mal resultado, por lo que al año siguiente repitieron la experiencia en 3 casos pero a través de uterostomía con muy buenos resultados.[ Para el año 2009 se estimaba en USA unos 400 fetos con MMC operados. Por eso surgió la necesidad de realizar un estudio randomizado que comparara resultados de los niños operados en útero con los operados postnatalmente. Así surgió el MOMS (Management of Myelomeningocele Study) que reclutó 100 pacientes con MMC operados intrautero y 100 postnatalmente en 3 Centros únicamente: San Francisco, Vanderbilt y Philadelphia, y no se permitió realizar ninguna cirugía fetal en USA hasta no obtener los resultados del MOMS. El objetivo primordial del estudio fue determinar si la reparación intrauterina del MMC entre las semanas 19 y 25 de gestación, mejoraba la evolución de los niños en dos parámetros: muerte y necesidad del shunt antes del año. Otros objetivos del estudio fueron determinar si la cirugía fetal reducía el número de casos de malformación de Chiari y la evolución neurológica de los niños evaluada a través de neuroimágenes, análisis neuromotor, test cognitivo y de neurodesarrollo, evaluados a los 12 y 30 meses de edad. También se evaluó el estado psicológico y capacidad reproductiva a largo plazo de las madres sometidas a cirugía fetal comparadas con el grupo postnatal. La evaluación de los dos grupos de niños (los operados pre y los operados postnatalmente) fue realizada por equipos de pediatras independientes que no conocían a que grupo pertenecía cada niño. Los criterios de inclusión y exclusión fueron muy estrictos. Criterios de inclusión: embarazo único, MMC entre T1 y S1, cariotipo normal, edad gestacional entre 19 y 25.9 semanas, presencia de Chiari por resonancia, edad materna mayor de 18 años y residencia en USA. Criterios de exclusión: embarazo múltiple, ecocardiograma fetal anormal, incompetencia de cuello uterino, severa cifosis, anomalías fetales no relacionadas al MMC, histerotomía previa, obesidad materna, riesgo de parto prematuro y ablución placentaria. Los resultados del MOMS publicados en 2011 en The New England Journal of Medicine[ Los resultados comparando la cirugía prenatal con la postnatal fueron: en la cirugía prenatal no hubo muerte materna, el promedio de edad gestacional fue de 34.1 semanas, sólo 40% de los niños requirieron shunt, no se evindenció Chiari en el 36%, el neurodesarrollo a los 30 meses fue significativamente mejor, el nivel motor 2 o más niveles fue mejor que lo esperado, el 42% logró caminar sin equipamiento, no hubo mejoría en la función urinaria y hubo una muerte fetal. En la cirugía postnatal no hubo muerte materna, el promedio de edad gestacional fue de 37.3 semanas, el 82% de los niños requirieri shunt, no se evidenció de Chiari en el 4%, solo el 21% caminó sin equipamiento, no hubo mejoría en la función y hubo una muerte fetal. Ambas cirugías, pre y postnatal tuvieron efectos adversos: en prenatal hubo riesgo de ruptura espontánea de membranas en el 46%, oligohidramnios en el 21% y parto prematuro en el 79%; en cambio en la cirugía postnatal el riesgo de ruptura espontánea de membranas fue de 8%, oligohidramnios en el 4% y parto prematuro en el 15%. Sus conclusiones fueron: la cirugía fetal reduce la necesidad del shunt, resuelve el Chiari y mejora la actividad motora a los 30 meses de edad, pero está asociada a riesgo de prematurez y dehiscencia uterina durante el parto. A partir de estas conclusiones comenzaron a surgir equipos de cirugía fetal en todo el mundo, pero lamentablemente, muchos de ellos, en su afán de protagonismo, olvidaron cumplir estrictamente los criterios de inclusión. Ello nos obligó a la Directiva del Capítulo Pediátrico de la FLANC a presentarnos en algunos países a conversar con las respectivas Asociaciones de Neurocirugía para que intervengan en esas situaciones irregulares, con resultado positivo en algunos casos y en otros no. ¿Es realmente el feto un paciente? La cirugía fetal ha revolucionado los campos de la bioética y filosofía. El concepto del feto como paciente y la determinación del momento exacto en que comienza la vida humana son dos tópicos altamente controversiales. Muchos creemos que es éticamente, médicamente y científicamente correcto tratar al feto como paciente dado que ello influirá en la calidad de vida que tendrá después del nacimiento, cuando adquiera un estatus moral y su propia personalidad. Los principios religiosos y éticos varían de una cultura a otra, pero la diferencia fundamental reside en considerar al feto como ser humano que merece el mismo tratamiento y respeto que un niño o como una entidad sujeta a cambios dinámicos que solo puede ser considerado ser humano después del nacimiento. En el 21° Congreso Europeo de Medicina Perinatal realizado en Estambul en 2008 se estableció que más allá de las diferencias culturales, nacionales, religiosas y sociales en Medicina Perinatal es importante respetar permanentemente los códigos éticos. Hay que tener en cuenta que el feto es totalmente dependiente de la madre gestante y que al operar al feto se viola la integridad de la madre. Hay que ser honesto cuando se provee información a la pareja: ni sobreestimar los beneficios ni subestimar los riesgos de la cirugía fetal. Es decisión exclusiva de la madre aceptar o rechazar la cirugía fetal. En los años 70 comenzó a gestarse la idea de que si bien el feto no es una persona humana, posee todo el potencial para transformarse en ello en el futuro. Sin embargo, el debate continua y las opiniones son muy dispares. La mayoría de los países europeos no consideran al feto como “potencial persona” y por lo tanto aceptan el aborto. Por ejemplo, en Bélgica la Corte Constitucional dictó el articulo 146/2011 que dice que el feto no nacido no puede reclamar derecho a la vida. En los Países Bajos otro juicio de valor similar fue hecho por la Corte de Dordrecht en 2012. En el caso de Vo versus Francia un procedimiento ginecológico le produjo un aborto a una paciente y la Convención Europea Para la Protección de Derechos Humanos y Libertades Fundamentales determinó que ese procedimiento lesionó a la madre, pero no fue considerada la muerte de una persona (feto). En otro caso similar en el Reino Unido, Evans versus Inglaterra, la Corte dictaminó que el derecho a la vida no se extiende al embrión. Sin embargo, hay diferentes puntos de vista. Así, en 1978 la Convención Latinoamericana de Derechos Humanos estableció en su artículo 4.1 que “toda persona tiene derecho a que su vida sea respetada… desde el momento de la concepción”. El Congreso de Norte América estableció en 1999 “que todo asalto violento contra una mujer gestante es considerado un crimen contra dos víctimas”. Las leyes argentinas siguen esta línea de razonamiento. Como vemos las opiniones son muy dispares. Los especialistas en cirugía fetal deben ser entrenados adecuadamente y solo debe ser realizada en grandes centros especializados. La experiencia mostrada en esta presentación del Hospital Austral revela a todas luces que ellos lo están. En el futuro otras patologías congénitas se beneficiarán con la cirugía fetal y se evitaran los estragos que producen en la vida postnatal como el encefalocele, el aneurisma de la ampolla de Galeno, la hidrocefalia, etc. ¿Por qué la Neurocirugía Fetal es importante en Latinoamérica? La población de Latinoamérica es de 576 millones de habitantes, de los cuales 164 millones son pobres y desnutridos, 60% de los cuales son extremadamente pobres. Solo el 15% de las mujeres consumen ácido fólico. El aborto es ilegal en la mayoría de los países de la región, de manera que nacen 576.000 niños con MMC por año.[ Con respecto a la presentación que estamos comentando, si bien el follow up es reducido, presentando edad media de los pacientes 10.2 meses, los resultados obtenidos son muy buenos, ya que son similares a los del MOMS. Estamos de acuerdo con los autores que debe lograrse en el futuro un acceso uterino menos invasivo, pero por el momento, los pocos grupos que lo han intentado con técnica endoscópica han tenido muy malos resultados, pese a que algunos artículos dicen lo contrario. En mi visita a uno de esos centros, constaté los malos resultados. Por el momento, la técnica descripta por los autores de este artículo es la absolutamente correcta. En lo que no estoy de acuerdo con los autores es en la ampliación de uno de los criterios de inclusión, que es precisamente la edad gestacional, ya que en el MOMS se exige una edad gestacional no mayor de 25.9 semanas, sin embargo aquí los autores, sin fundamento científico, han incluido gestantes de hasta 27.6 semanas. También en el texto se sugiere que incluyeron casos con cesárea previa, los cuales son excluidos pro el MOMS. Si bien esto les ha permitido aumentar el número de casos y por ende la curva de aprendizaje, a mi entender este es un punto que debe ser muy crítico. Sí me parece muy prudente que hayan incluido la exigencia de poder permanecer la gestante y su acompañante en las proximidades del Hospital Austral durante el periodo que comprende desde la cirugía fetal al nacimiento. Es importante la observación que hacen los autores para la técnica quirúrgica, de que el parche dural, útil como reemplazo de duramadre, les resultó inútil como reemplazante de la piel. En el único caso que nosotros lo usamos como sustituto de la piel, fue rechazado por el feto y al nacimiento, no solo estaba desprendido, sino que al retirarlo y dejar que cicatrice por segundas, quedó una cicatriz muy pronunciada. No obstante, el grupo de Saint Louis, con sobrada experiencia en Neurocirugía Fetal lo aconseja su uso. Como conclusión podemos decir que los autores están realizando un excelente trabajo en Neurocirugía Fetal, que demuestran ser un equipo muy estructurado, nada improvisado y con sobrada experiencia en cada uno de los campos de la Cirugía Fetal. Seguramente a medida que su curva de aprendizaje progrese, sus resultados serán aún mejores.
References
1. Patten BM. Embryological stages in the establishing of myeloschisis with spina bifida. Am J Anat. 1953. 93: 365-95
2. Cameron AH. The spinal cord lesion in spina bifida cystica. Lancet. 1956. 271: 171-4
3. Hutchins GM, Meuli M, Meuli-Simmen C, Jordan MA, Heffez DS, Blakemore KJ. Acquired spinal cord injury in human fetuses with myelomeningocele. Pediatr Pathol Lab Med. 1996. 16: 701-12
4. Tulipan N, Bruner JP. Myelomeningocele repair in utero: A report of three cases. Pediatr Neurosurg. 1998. 28: 177-80
5. Sutton LN, Adzick NS, Bilaniuk LT, Johnson MP, Crombleholme TM, Flake AW. Improvement in hindbrain herniation demonstrated by serial fetal magnetic resonance imaging following fetal surgery for myelomeningocele. JAMA. 1999. 282: 1826-31
6. Adzick NS, Thom EA, Spong CY, Brock JW, Burrows PK, Johnson MP. A randomized trial of prenatal versus postnatal repair of myelomeningocele. N Engl J Med. 2011. 364: 993-1004
7. Zuccaro G. Why fetal neurosurgery?. Childs Nerv Syst. 2017. 33: 1081-2
Commentary
Comentario
Roberto Jaimovich- Hospital de Pediatría Prof. Dr. J. P. Garraham, CABA, Buenos Aires, Argentina
La cirugía antenatal a fetos con mielomeningocele se ha instalado como una alternativa válida al tratamiento en estos pacientes.
El presente artículo muestra la mayor casuística en nuestro país y replica los resultados de la bibliografía alentados por el estudio MOMS.
Se informa acerca de las complicaciones relacionadas al embarazo, aunque no menciona si hubo otras complicaciones maternas de índole clínico-general.
Siendo la prematurez la mayor complicación para el recién nacido, consecuencia del procedimiento realizado, al igual que en el estudio MOMS, faltan presentar las complicaciones clínicas resultantes de la misma y compararla con un grupo de pacientes operados al nacer.
En este grupo de pacientes se logró un porcentaje menor de desarrollo de hidrocefalia comparado al de otras publicaciones. Sería interesante conocer que decidió a los autores a optar por una TVE o por una DVP.
Son conocidos los pros y contras de la cirugía antenatal del mielomeningocele realizada de forma abierta y de la realizada por fetoscopía. Esta última realizada por vía laparoscópica materna parecería tener un menor riesgo de prematurez, pero deben mejorarse las técnicas para evitar la mayor incidencia de dehiscencia o fístula en el sitio reparado.
La cirugía materno-fetal para tratar el paciente con mielomeningocele, debe ser sólo ofrecida a pacientes cuidadosamente seleccionados, informando adecuadamente a los padres para que tengan una libre elección, y en centros médicos con equipos multidisciplinarios con expertice e instalaciones que puedan brindar cuidados intensivos a la madre y al recién nacido.
Grupos multidisciplinarios como el de los autores, pueden dar los pasos futuros para mejorar el “outcome” de estos pacientes.
Commentary
Comentario
Alberto Yañez- Hospital Pedro de Elizalde, CABA, Buenos Aires, Argentina
Desde finales de la década de los 90 la cirugía fetal se ha constituídoconstituido en una nueva herramienta terapéutica para el tratamiento de los defectos del tubo neural, particularmente el mielomeningocele. Las distintas publicaciones muestran que en los casos seleccionados se verificó una reducción significativa de la necesidad de colocación de un sistema de derivación por hidrocefalia y una importante mejoría en la función motora.
La reparación quirúrgica antenatal debe tener como objetivo principal una mejoría en la función motora postnatal y considerar las complicaciones del procedimiento. Quedan distintos aspectos por resolver como la falta de trofismo del líquido anmióticoamniótico, el rol de la prevención, los factores epigenéticos y los costos sociales.