- Department of Surgery, The Center for Advanced Neurology and Neurosurgery, Porto Alegre, Rio Grande do Sul, Brazil,
- Department of Neurosurgery, Hospital Padila, Country Las Yungas, Yerba Buena, Tucumán,
- Department of Neurosurgery, Hospital Italiano de Buenos Aires, Perón, Buenos Aires, Argentina,
- Serviço de Neurocirurgia, Hospital Ministro Costa Cavalcanti Sanatório Le Blanc, Rua Joao Rouver, Foz do Iguaçu, Parana,
- Department of Neurosurgery, Pontifical Catholic University of Rio Grande do Sul, Luciana de Abreu, Porto Alegre,
- Department of Neurosurgery, Center for Advanced Neurology and Neurosurgery, São Leopoldo, Rio Grande do Sul, Brazil.
Correspondence Address:
Gustavo Rassier Isolan
Department of Neurosurgery, Center for Advanced Neurology and Neurosurgery, São Leopoldo, Rio Grande do Sul, Brazil.
DOI:10.25259/SNI_679_2020
Copyright: © 2020 Surgical Neurology International This is an open-access article distributed under the terms of the Creative Commons Attribution-Non Commercial-Share Alike 4.0 License, which allows others to remix, tweak, and build upon the work non-commercially, as long as the author is credited and the new creations are licensed under the identical terms.How to cite this article: Gustavo Rassier Isolan1, Alvaro Campero2, Pablo Marcelo Ajler3, Edgar Manuel Farina4, Thomas More Frigeri5, Leandro Infantini Dini6. El lóbulo de la ínsula: Parte 2 - anatomía microquirúrgica y correlación clínico-quirúrgica. 11-Dec-2020;11:
How to cite this URL: Gustavo Rassier Isolan1, Alvaro Campero2, Pablo Marcelo Ajler3, Edgar Manuel Farina4, Thomas More Frigeri5, Leandro Infantini Dini6. El lóbulo de la ínsula: Parte 2 - anatomía microquirúrgica y correlación clínico-quirúrgica. 11-Dec-2020;11:. Available from: https://surgicalneurologyint.com/surgicalint-articles/10439/
Abstract
Antecedentes: El conocimiento profundo de la anatomía microquirúrgica del lóbulo de la ínsula es crucial para operar pacientes con tumores en esta región. El objetivo de la segunda parte de este estudio es correlacionar la anatomía microquirúrgica con casos ilustrativos retirados de nuestra casuística de 35 pacientes en los cuales fueron realizados 44 cirugías de tumores en relación con el lóbulo de la ínsula.
Métodos: A lo largo de marzo de 2007 y agosto de 2014, 44 microcirugías fueron realizadas en 35 pacientes portadores de tumores insulares y los hallazgos de las cirugías y mapeo cerebral se correlacionaron con la anatomía microquirúrgica.
Resultados: De una serie de 44 pacientes con tumores de la ínsula, la mayoría de los casos eran gliomas de bajo grado de malignidad (29 casos). El inicio de los síntomas en 34 pacientes fue epilepsia, siendo esta refractaria al tratamiento medicamentoso en 12 casos. El grado de resección fue subtotal o total en la mayoría de los casos de la serie. La mejoría en la calidad de vida (epilepsia, etc.) estuvo presente en más de la mitad de los pacientes. El dé cit neurológico permanente estuvo presente en tres pacientes.
Conclusión: En los tumores insulares, es tan importante el conocimiento profundo de la anatomía, como el saber utilizar e interpretar en tiempo real las observaciones de la monitorización neuro siológica intraoperatoria.
Keywords: Lóbulo de la Ínsula, Anatomía microquirúrgica, Morbilidad, Epilepsia, Calidad de Vida
INTRODUCCIÓN
El objetivo de la segunda parte de este estudio es correlacionar la anatomía microquirúrgica con casos ilustrativos retirados de nuestra casuística de 35 pacientes en los cuales fueron realizados 44 cirugías de tumores envolviendo el lóbulo de la ínsula, siendo 40 cirugías de pacientes portadores de gliomas de ínsula y 4 cirugías en pacientes con otras lesiones (1 metástasis de melanoma, 2 1 linfoma).
Los resultados estadísticos y de sobrevida de esta serie serán presentados en estudios subsecuentes. En el presente estudio buscamos evidenciar la importancia de una perspectiva anatómica y funcional (con mapeo cerebral para casos seleccionados) en las cirugías de esta comple- ja región cerebral.
MATERIALES Y MÉTODOS
A lo largo de marzo de 2007 y agosto de 2014, 44 micro neurocirugías fueron realizadas en 35 pacientes portado- res de tumores insulares. La presentación de síntomas, examen neurológico completo y Karnofsky Performan- ce Scale (KPS) fueron evaluadas en cada paciente an- tes y después de la cirugía.[
A partir de 2009, todos los pacientes fueron someti- dos a exámenes neuropsicológicos pre y posoperatorios. La localización del glioma fue clasificada de acuerdo con Yaşargil y de acuerdo con la clasificación de Berger y Sa- nai. Con base en esta clasificación (Yaşargil), tumores tipo 3 son restrictos a la ínsula, o a partes de la misma (Tipo 3A), o pueden incluir los opérculos correspondien- tes (Tipo 3B). Tumores Tipo 5, por su parte, -compro- meten más allá de la ínsula y el opérculo envolviendo una o ambas áreas orbitofrontal y áreas temporopolar, con (Tipo 5B) o sin (Tipo 5A), o partes del sistema límbico medial.
Se utilizó potencial evocado motor y somato sensorial con estimulación cortical y subcortical con el objetivo de verificar la integridad anatómica y funcional de las vías piramidales; esto realizado en 34 cirugías. Estimulación cortical y subcortical con pacientes despiertos fueron rea- lizadas en los últimos 4 años en todos los pacientes por- tadores de gliomas insulares en el hemisferio dominante. Ultrasonografía intraoperatoria fue utilizada en 12 casos seleccionados de esta serie, principalmente en los volumi- nosos tumores con extensión posterior. No indicamos re- sonancia magnética intraoperatoria o neuronavegación de rutina.
Todos los pacientes fueron examinados inmediatamente después de la cirugía: en el primer y en el tercero mes posoperatorio, y después cada 6 meses. La resonancia magnética fue realizada en todos los casos, después de tres meses de posoperatorio, y después cada 6 meses posterior a la cirugía. Utilizamos abordaje trans-silviano en todos los casos en el inicio de esta serie.
A partir de 2011 modificamos la técnica y comenzamos a realizar operculotomía después del mapeo cortical con el paciente despierto para tumores en el hemisferio domi- nante y mantuvimos la técnica transilviana para pacien- tes con tumores localizados en los hemisferios derechos o izquierdos pero restrictos a la ínsula y sin extensión neo- cortical.
Los pacientes fueron operados en el Centro Avança- do de Neurología y Neurocirugía (CEANNE), Hospi- tal Centenario de São Leopoldo, en el Centro de Tumo- res Cerebrales del Hospital Moinhos de Vento de Porto Alegre y en el Hospital de Clínicas de Porto Alegre de la Universidad de Federal de Rio Grande do Sul.
TÉCNICA QUIRÚRGICA
Tumores del lóbulo de la ínsula en hemisferio no dominante o hemisferio dominante con paciente con anestesia general
La cabeza del paciente fue fijada en el fijador de tres pun-tos Mayfield-Kees, realizando después leve extensión y rotación de 30 grados de esta para el lado opuesto al tu- mor. El paciente fue mantenido en decúbito dorsal y con el dorso elevado en 30 grados.
El colgajo de piel fue dislocado anteriormente y una disección subfacial fue realizada.
La craneotomía fue iniciada con un único orificio de trepanación luego detrás y arriba de la sutura frontozi- gomática y otro orificio localizado en la porción más pos- terior de la línea temporal superior. La duramadre fue di- secada y separada del hueso con disector. Después fue realizada craneotomía frontotemporal con extensión posterior. La duramadre fue anclada en el borde de la craneotomía, el ala del esfenoides fue removida extraduralmen- te y la duramadre fue abierta en forma de “C” sumada de dos incisiones posteriores de descarga. El próximo paso fue la disección microquirúrgica de la fisura silviana.
Al abrir la fisura silviana, el primer paso fue reconocer el punto silviano anterior y la rodilla de la fisura Silvia- na, lugar donde se evidencia el cambio de la dirección del segmento esfenoidal y lateral.
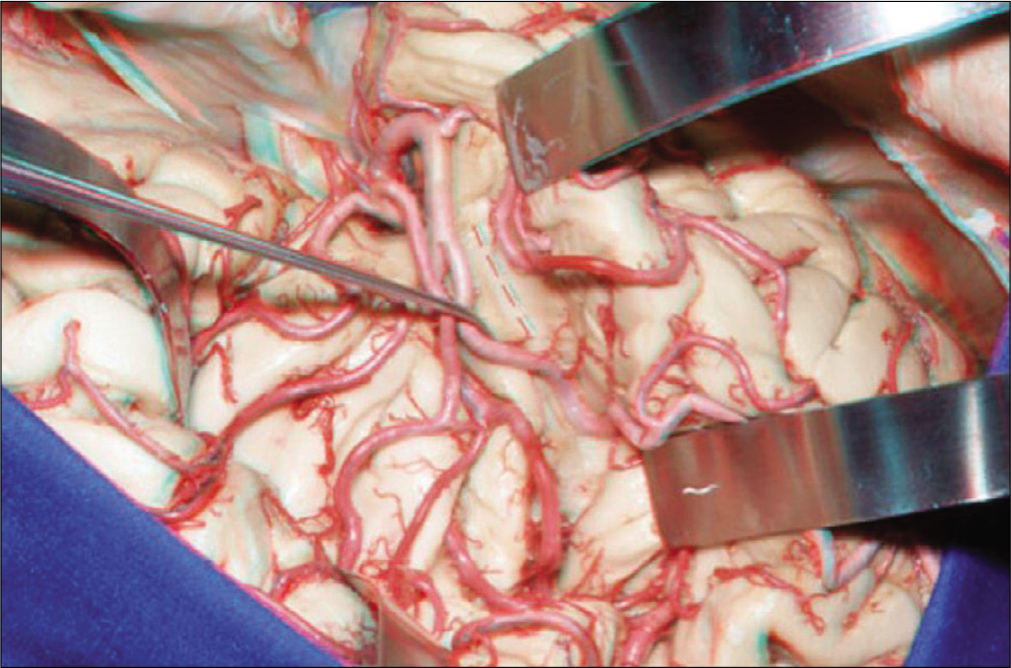
La disección microquirúrgica de la fisura silviana tie- ne como objetivo separar los opérculos frontal y temporal creando así un amplio corredor anatómico para la resec- ción tumoral del glioma insular, que forma el piso de este corredor. Para eso iniciamos la disección lo más posterior posible, eligiendo generalmente un surco cortical poste- rior al giro temporal transverso anterior y avanzamos an- teriormente hasta alcanzar la profundidad de la cisterna silviana. Usamos lámina de bisturí recta número 12 y as- pirador de microcirugía. No usamos espátula para sepa- rar el cerebro prácticamente durante toda a cirugía, sien- do reservado su uso para el final de la resección tumoral. Al abrir y disecar toda la extensión de la fisura silviana identificamos el tejido tumoral de color “blanco nacara- do” en la superficie insular que corresponde al glioma (en la mayoría de las veces de bajo grado de malignidad, esto es, macroscópicamente similar al tejido cerebral normal). Luego se diseca las cisternas carotideas, quiasmática y las otras cisternas de la base para tener amplia visualiza- ción y control de las arterias carótida interna, coroidea anterior, comunicante posterior, cerebral anterior y cere- bral media, también localizamos la posición de los ramos perforarte de las arterias cerebral media y cerebral ante- rior dirigiéndose para la substancia perforada anterior.
Cuando existe componente tumoral, este no debe ser resecado debido a la posible lesión de los ramos vascula- res para la cápsula interna. Después de visualizar los giros cortos y largos de la ínsula (generalmente afectados por el tumor), partimos con la coagulación bipolar, evitando la coagulación de cualquier ramo de mayor calibre.
Procedemos a la corticotomía del córtex insular y a la resección tumoral con aspirador ultrasónico, con potencia de aspiración en 30 o menos para evitar lesión vascular. Después de la resección del componente tumoral de la región central de la ínsula, resecamos la porción del pla- num polare (en aquellos casos en que hay invasión del ló- bulo temporal) a través del surco circular inferior de la ínsula. Para tumores con extensión posterior puede ser necesario corticotomía de las porciones posteriores de los lóbulos frontal o temporal.
Después de identificadas y resecadas las porciones más laterales del tumor, continuamos para la porción medial del tumor, más peligrosa porque ya que está íntimamen- te relacionada con la cápsula interna. En esta parte de la cirugía realizamos estimulación intraoperatoria con esti- mulador bipolar. Cuando la eletroneuromiografía capta contracciones musculares en el hemicuerpo contralateral al tumor indica que el cirujano está próximo de la cápsula interna. Los estudios varían en la definición del momen- to en que debe ser suspendida la resección del componen- te medial del tumor. Hemos parado cuando el estímulo de 7 mA en la profundidad del campo operatorio genera un potencial eletroneuromiográfico en la cara o miembro superior del lado contralateral. Para gliomas que compro- meten el neocórtex, en vez de iniciar con la disección de la fisura silviana, iniciamos el procedimiento con cortico- tomía del giro comprometido y resección subpial de todo el tumor. La parte medial del tumor, continúa siendo re- secada como esta descripto anteriormente, o teniendo como límite de la resección basado en estimulación sub- cortical profunda.
Tumores en hemisferio dominante con el paciente despierto
Para aquellos pacientes con tumores de la ínsula localizados en el hemisferio izquierdo, en los últimos tres años, hemos usado resección quirúrgica con el paciente des- pierto (“awake surgery”). En esta técnica, el paciente es anestesiado solamente con propofol y remifentanil y, des- pués de ser realizada la craneotomía, el anestésico es sus- pendido y el paciente despierto es extubado. El paciente responde a los test de lenguaje (dependiendo del área cor- tical abordada) para la neuropsicóloga que se encuentra posicionada en frente del paciente y el cirujano realiza es- timulación cortical con 2.0 mA o subcortical variando de 4 mA (área del habla) a 7 a 20 mA (para localizar la dis- tancia entre la cápsula interna y la corona radiata). En lo que corresponde al lenguaje, la resección tumoral es sus- pendida al nivel topográfico en el cual el paciente presen- te repeticiones, parafasias o afasia. En relación a la mo-tricidad, la resección es interrumpida en el momento en que el paciente presenta incoordinación motora o debili-dad. La técnica es la misma utilizada para los tumores en los hemisferios no dominantes excepto en los casos en que sea necesario corticotomía (extensión tumoral en la re- gión posterior de la ínsula o tumores insulares que com- prometan al neocórtex).
RESULTADOS
De una serie de 44 pacientes con tumores de la ínsula, la mayoría de los casos eran gliomas de bajo grado de malignidad (29 casos). El inicio de los síntomas en 34 pacientes fue epilepsia, siendo esta refractaria al tratamiento medicamentoso en 12 casos. El grado de resección fue subto- tal o total en la mayoría de los casos de la serie. La mejo- ra en la calidad de vida (epilepsia, etc.) estuvo presente en más de la mitad de los pacientes. Déficit neurológico per- manente estuvo presente en tres pacientes. Los resulta- dos detallados incluyendo curva de sobrevida, calidad de vida y grado de resección con volumetría serán publica- dos en breve.
Casos ilustrativos con correlación anatómica
Las [
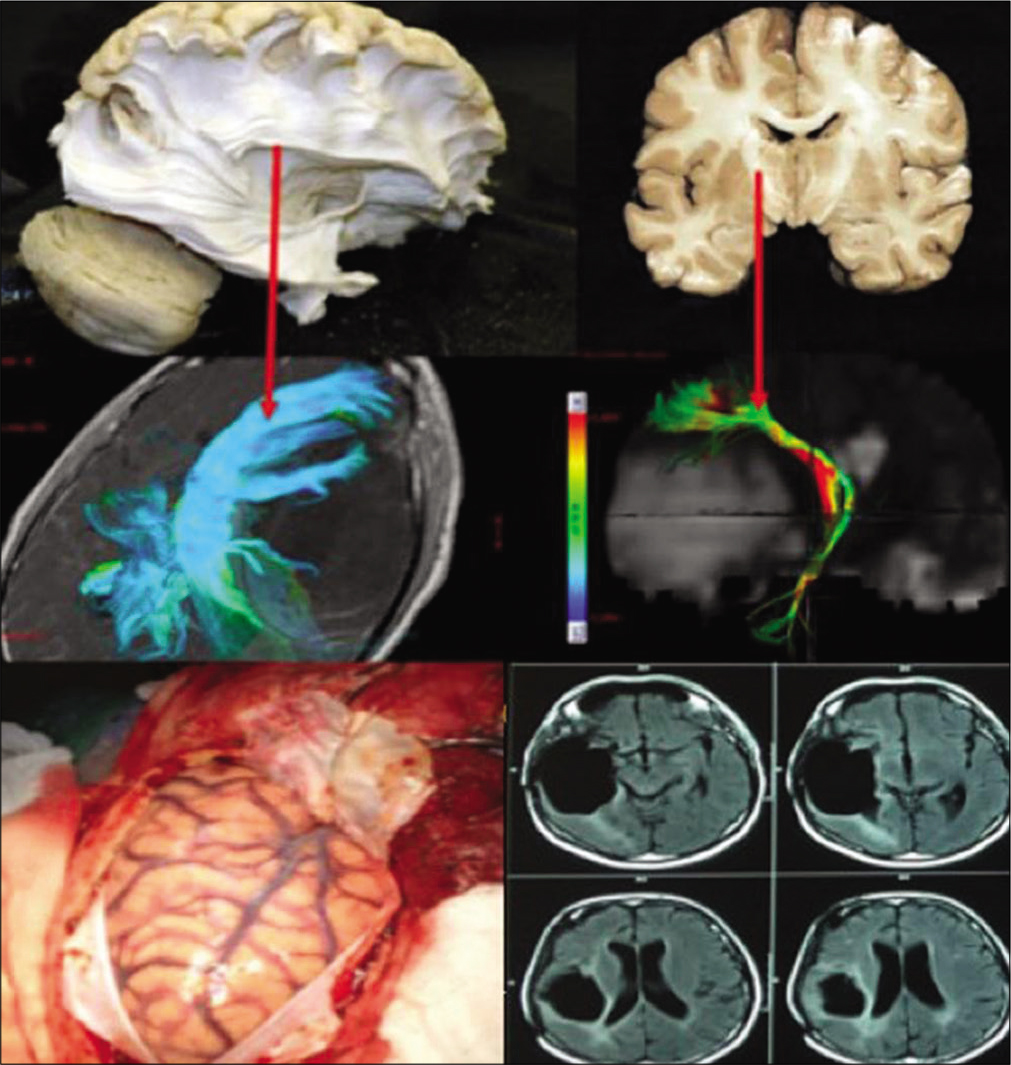
Figura 1:
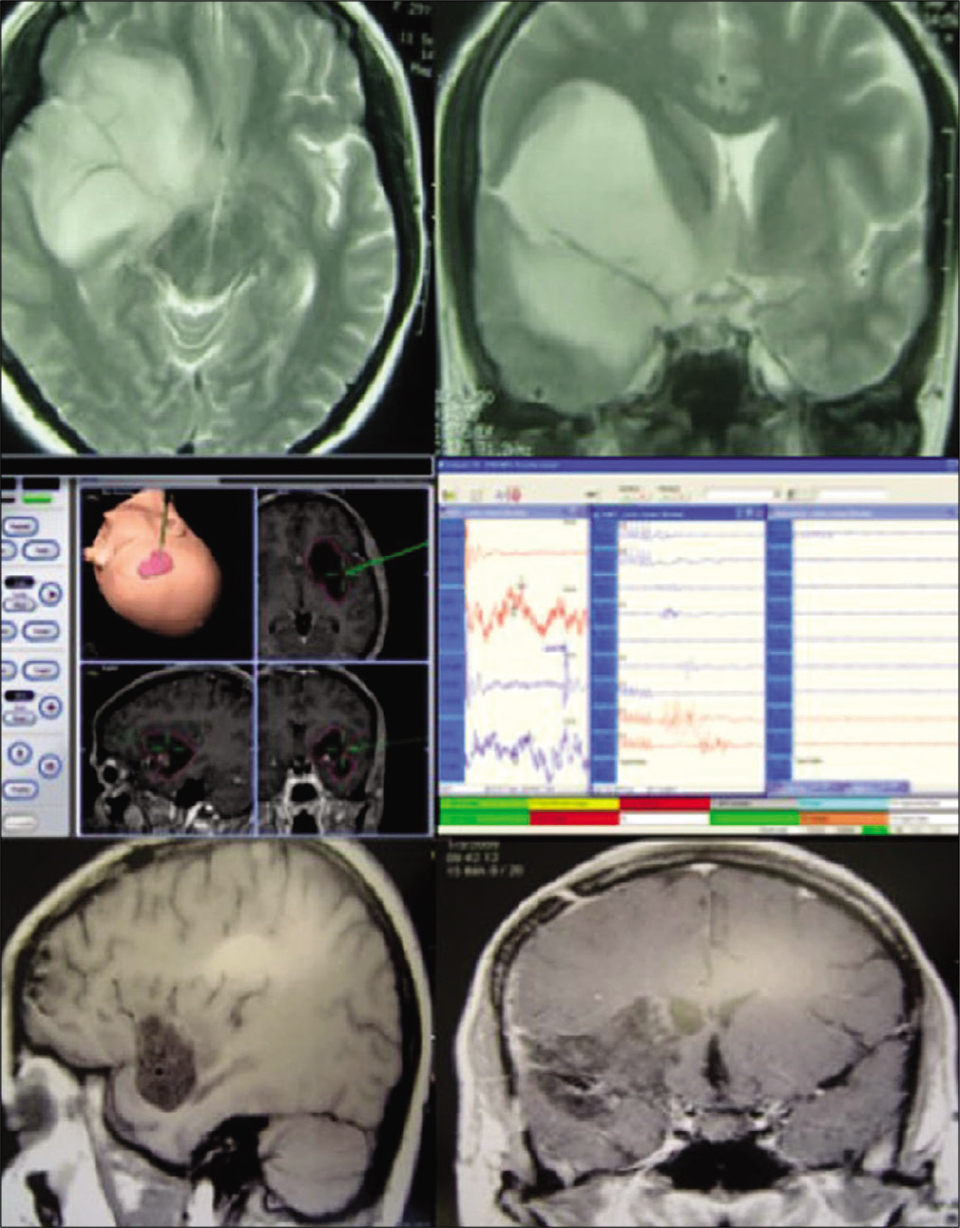
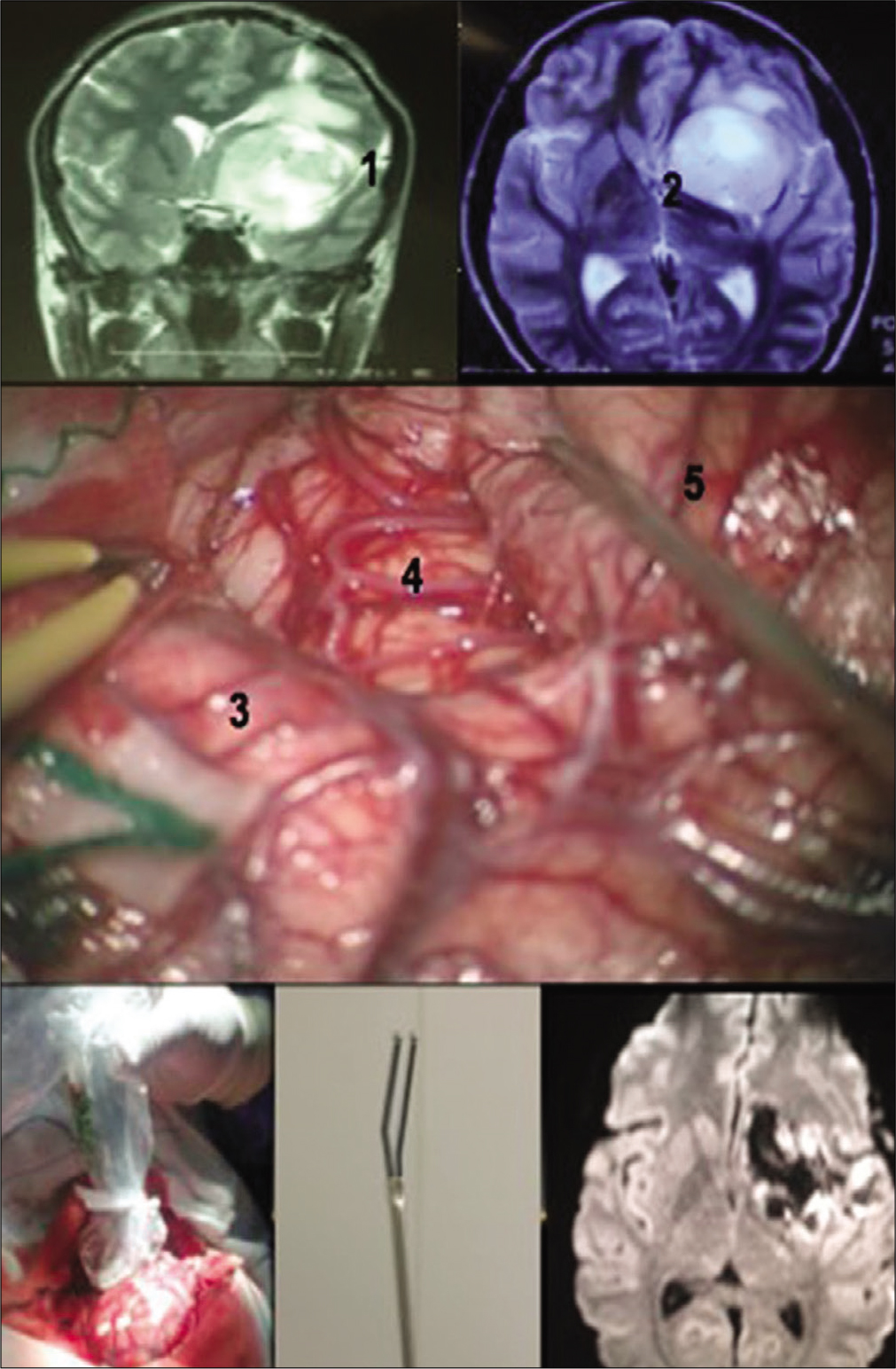
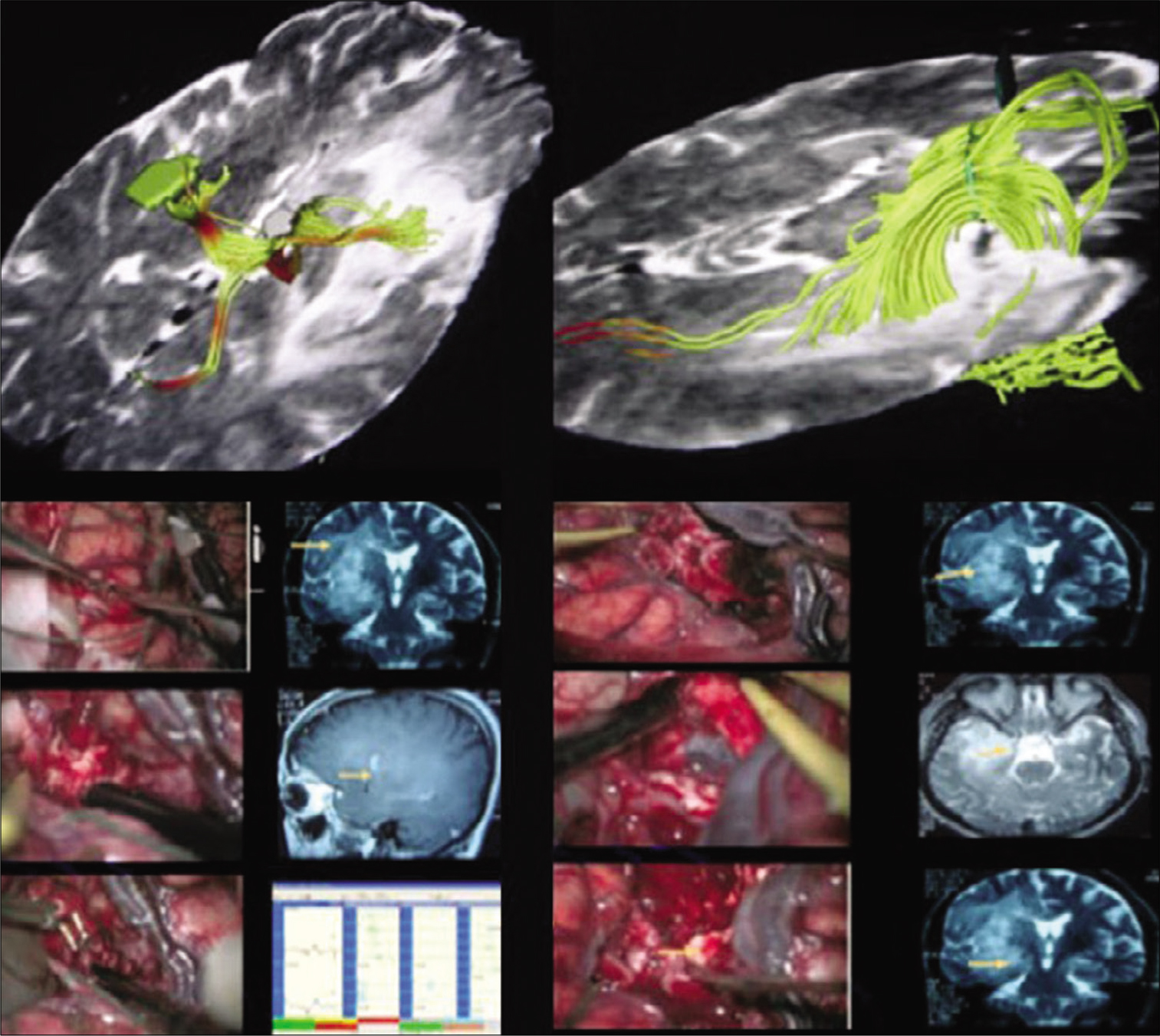
Disección de fibras blancas mostrando su relación del fascículo arqueado (superior izquierda) y del tracto cortico-espinal (superior derecha) con la tracto- grafía y la relación de estas fibras en paciente con glioma insular a la derecha (medio izquierda y derecha). La craneotomía debe ser extendida posteriormente bus- cando la apertura de toda la extensión de la fisura silviana (inferior Izquierda). Resonancia magnética en FLAIR evidenciando resecado total del tumor. Este paciente era portador de síntomas de hipertensión endocraneana y crises parciales complejas que desaparecieron con la cirugía. Paciente sin déficits posoperatorios.
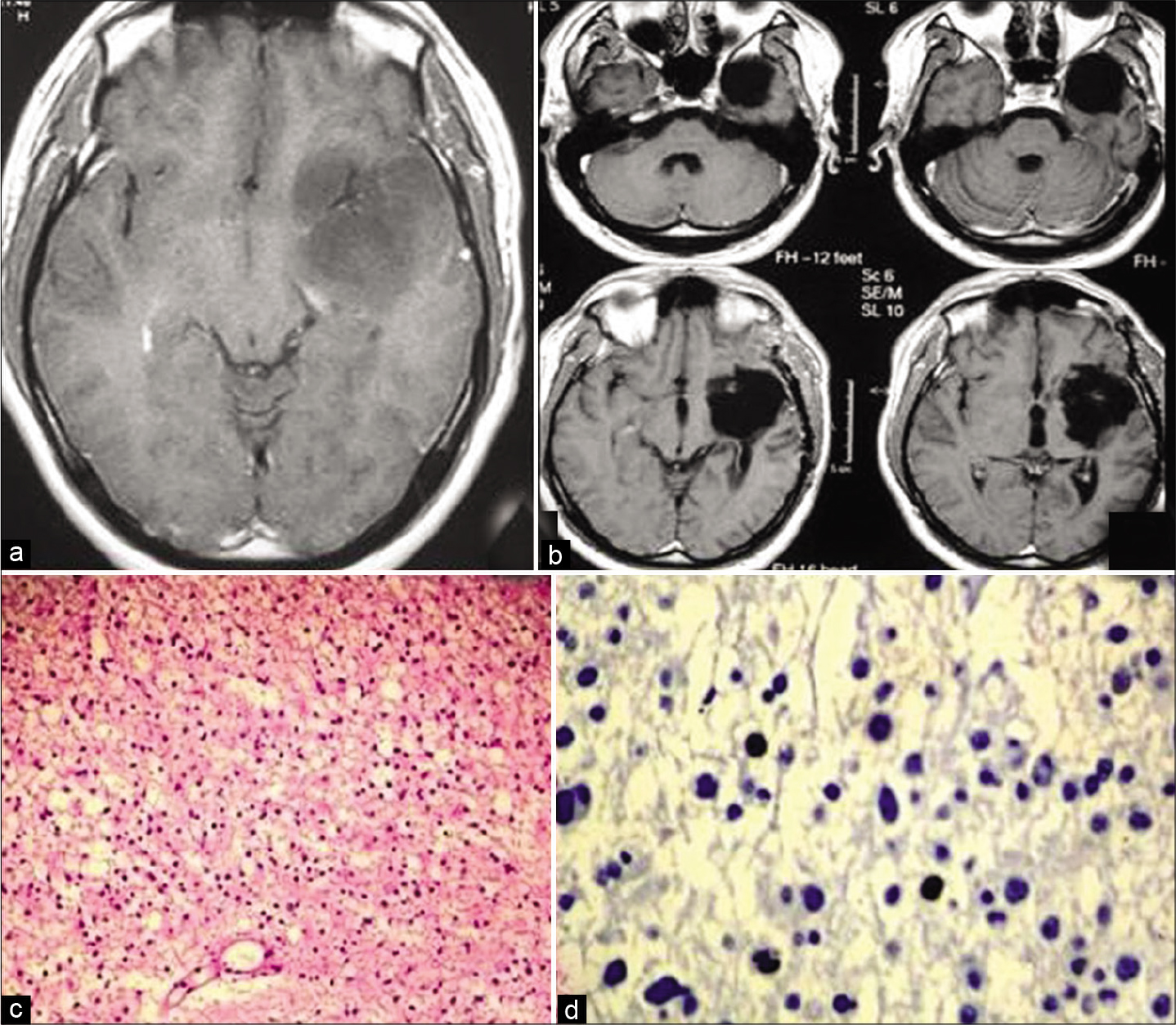
Figura 2:
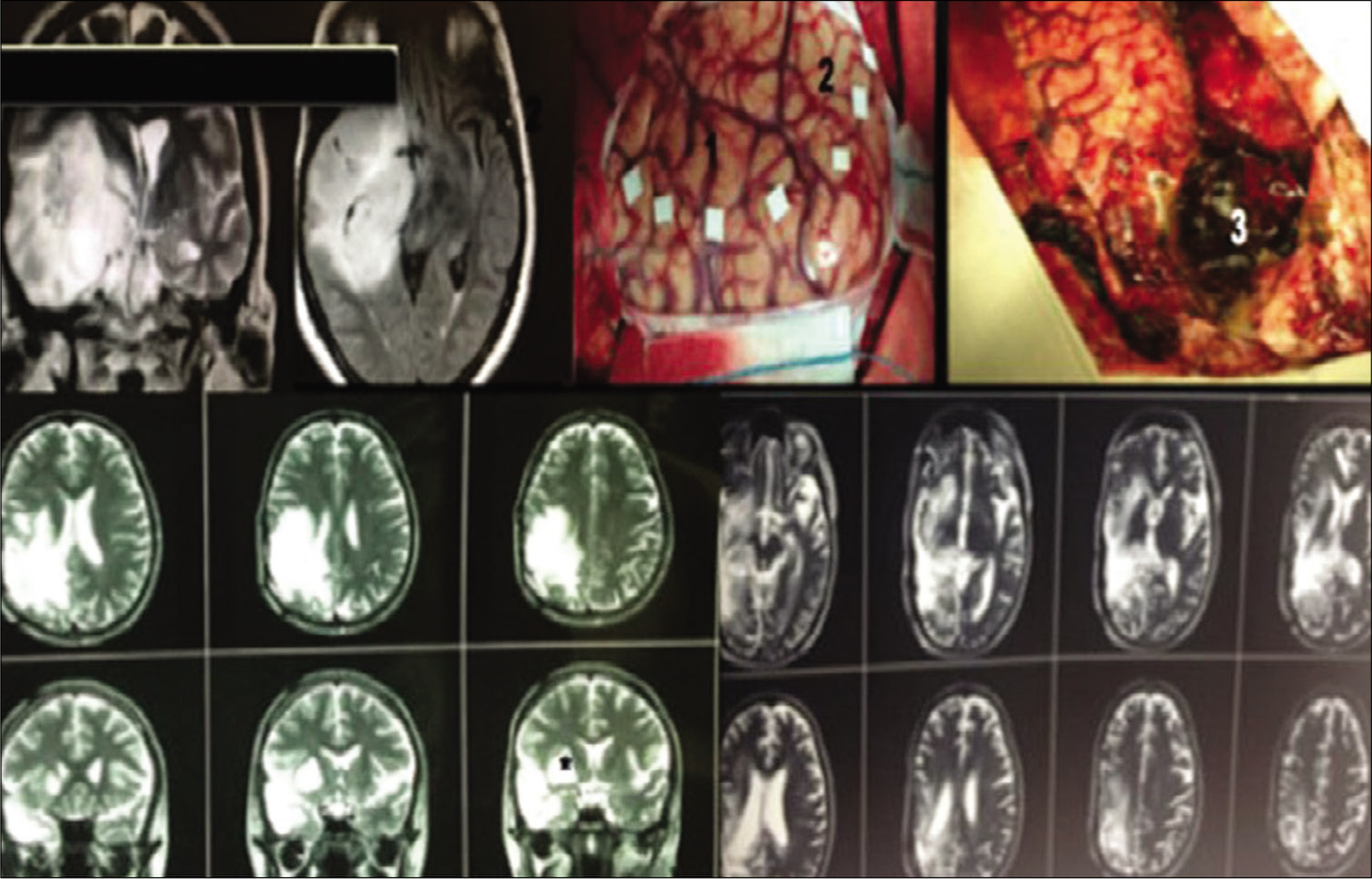
Este paciente era portador de un glioma insular de bajo grado a la izquierda causando epilepsia refractaria a los medicamentos. RNM en T1 con gadolinio evidenciando lesión hipo intensa sin realce por el contraste temporo-insular izquierda (a). Después abordaje transsilviano se obtuvo resección total del tumor (b). La cirugía resulto en afasia motora y hemiparesia que mejoraron parcialmente después de 6 meses. Este fue el segundo caso de la serie, cuando no utilizamos mapea- miento cortical. Histología evidenciando glioma grado II (c) con Ki-67 inferior a 5% (d).
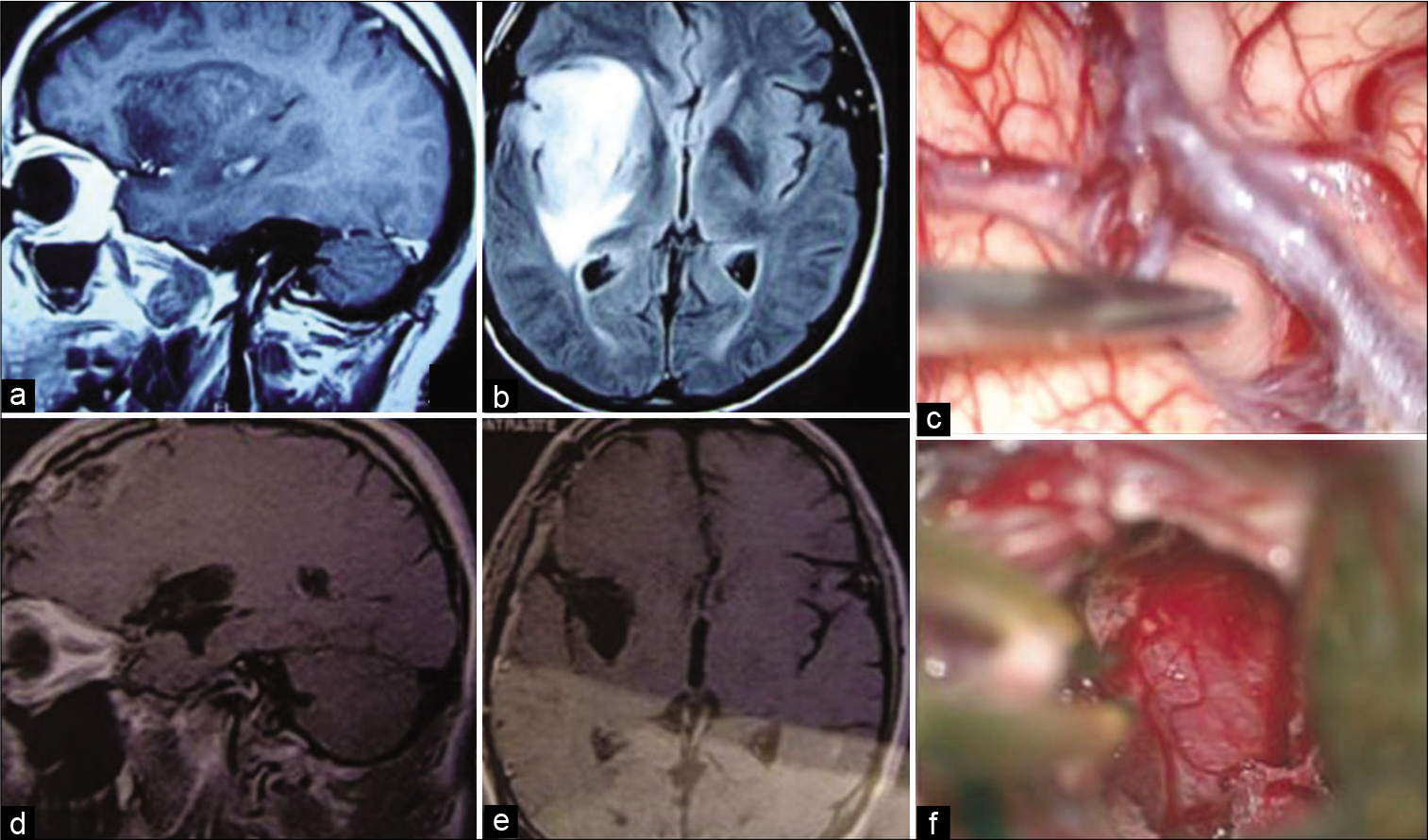
Figura 3:
Paciente masculino de 41 años con epilepsia parcial compleja con generalización secundaria controlada con carbamazepina. RNM sagital en T1 con gado- linio evidenciando tumor hipo intenso temporo-insular a la derecha con discreta captación de gadolinio (a). RNM axial en T2 evidenciando lesión hiperintensa en la ínsula sin invasión de la cápsula interna (b). Imagen intraoperatoria evidenciando visualización del tejido tumoral después disección de la porción más distal de la fi- sura silviana (c). RNM en T1 evidenciando resección subtotal (>90%) del tumor (d y e). Imagen intraoperatoria evidenciando aracnoides de las cisternas ambiens y crural después de resección del componente temporal mesial del tumor (f). Histología revelo oligoastrocitoma grado II
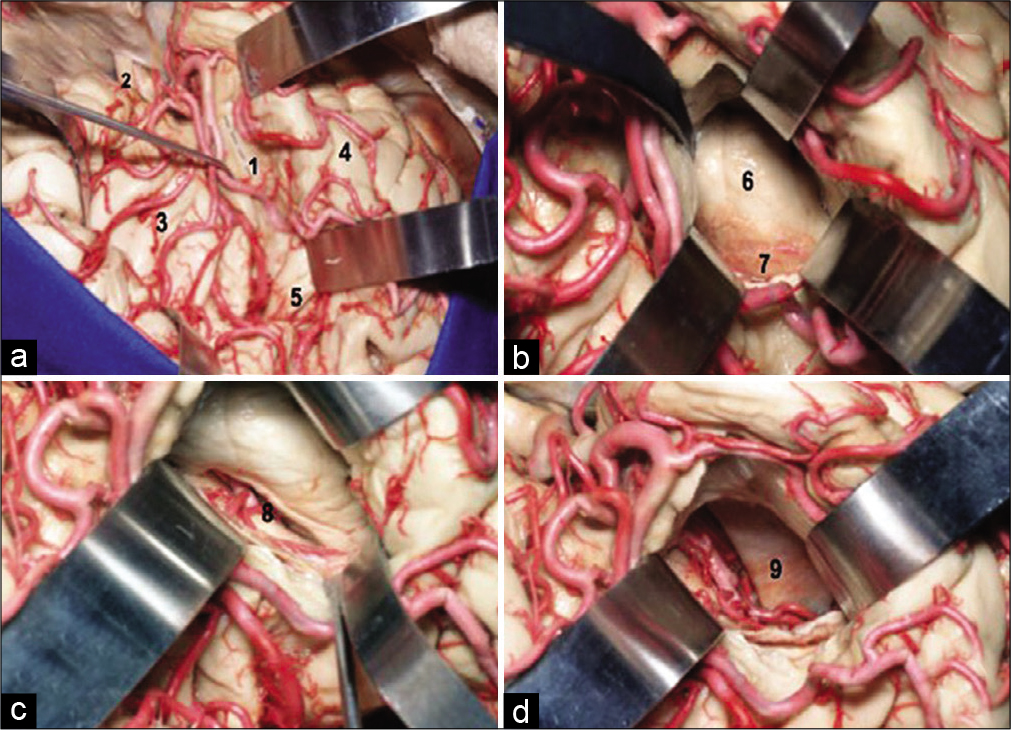
Figura 4:
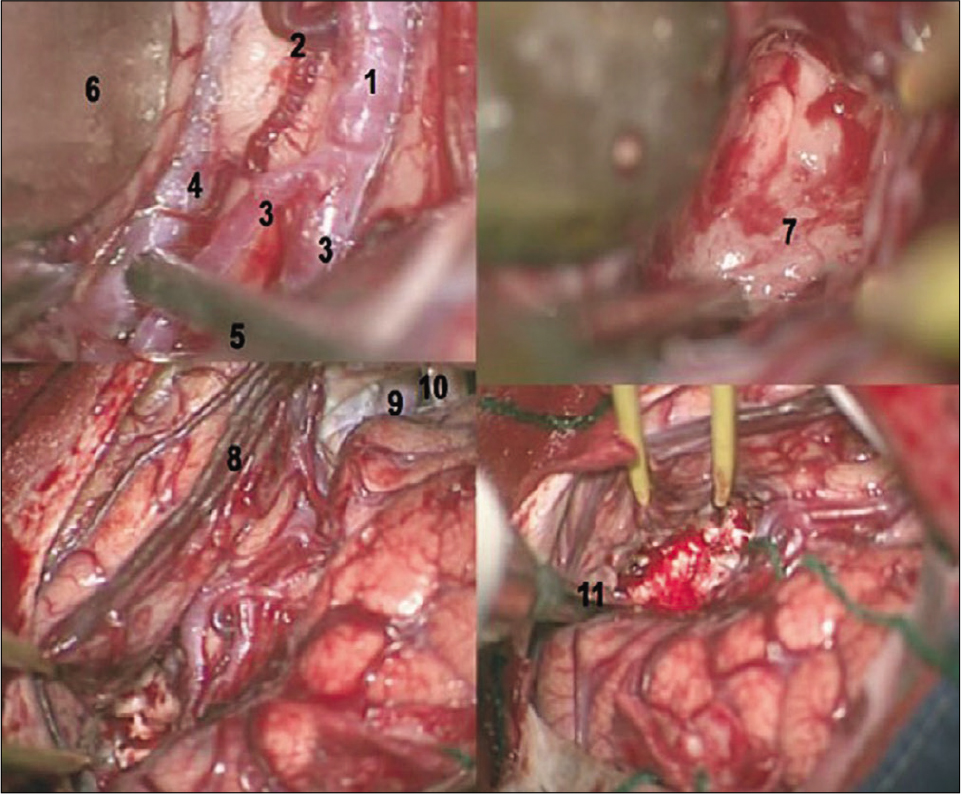
Visión anatómica de la fisura silviana derecha y su relación con las es- tructuras temporales mesiales. Después disección amplia de la fisura silviana es coagulada y aspirada la parte anterior del surco circular inferior de la ínsu- la (marcado) en dirección al cuerno temporal del ventrículo lateral (superior iz- quierda). A adentrar en el cuerno temporal visualizamos la cabeza del hipocampo (superior derecho) y la fisura coroidea (inferior izquierda). Después resección de las estructuras temporales mesiales visualizase la incisura de la tienda del cerebelo y las arterias y venas de la cisterna crural y ambiens (inferior derecha). (1) Surco circular inferior o peri-insular inferior; (2) Nervio óptico; (3) Giros insulares; (4) Giro temporal superior; (5) Giro de Heschel; (6) Cabeza del hipocampo; (7) Plexo coroidea; (8) Fisura coroidea (parte temporal);(9) Tienda del cerebelo.
Figura 7:
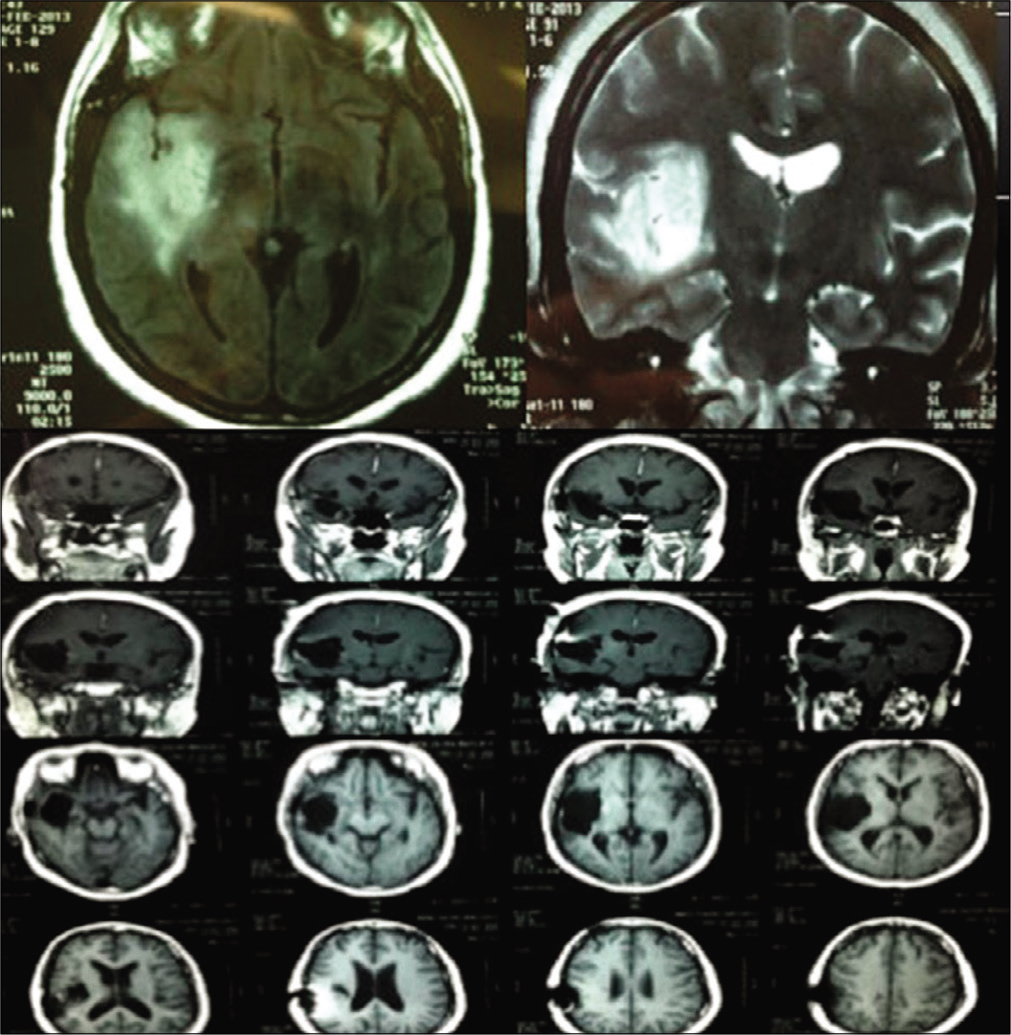
Paciente femenina de 29 años con voluminosos gliomas fronto-tempo- ro insular con cuadro inicial de crisis parciales complejas con generalización se- cundaria responsivas al tratamiento medicamentoso. RNM axial en T2 (superior izquierda) y coronal en T2 (superior derecha) evidenciando localización del tu- mor. En este caso fue utilizada neuro navegación que probo no ser útil para este tipo de tumor (central izquierda), siendo que el reconocimiento de las estructu- ras anatómicas y la estimulación subcortical para localización intraoperatoria de la cápsula interna (central derecha) fueron suficientes en la obtención de re- sección tumoral, superior a 95% (inferior izquierda e inferior derecha). Paciente despertó hemiparética de la cirugía, recuperándose totalmente del déficit en 6 horas. Histología revelo glioma grado II.
Figura 8:
Paciente femenina de 42 años con crisis parciales complejas y cri- sis generalizadas tónico-clónicas controladas con carbamazepina. Después de 2 años haciendo acompañamiento con RNMs a cada 6 meses evidenciamos au- mento tumoral, optando la paciente por cirugía. RNM axial en FLAIR (superior iz- quierda) y coronal T2 (superior derecha) evidenciando tumor insular hiperinten- so. Fue realizada abordaje trans-silviana con resección total del tumor (imagen central e inferior). El límite estipulado para suspender la resección medialmente fue captación del potencial eletroneuromiográfico con estimulo bipolar de 5 mA en la profundidad del tumor. Paciente despertó con fuerza grado III evo luyendo para fuerza grado V en 3 meses. Histología revelando glioma grado II.
Figura 9:
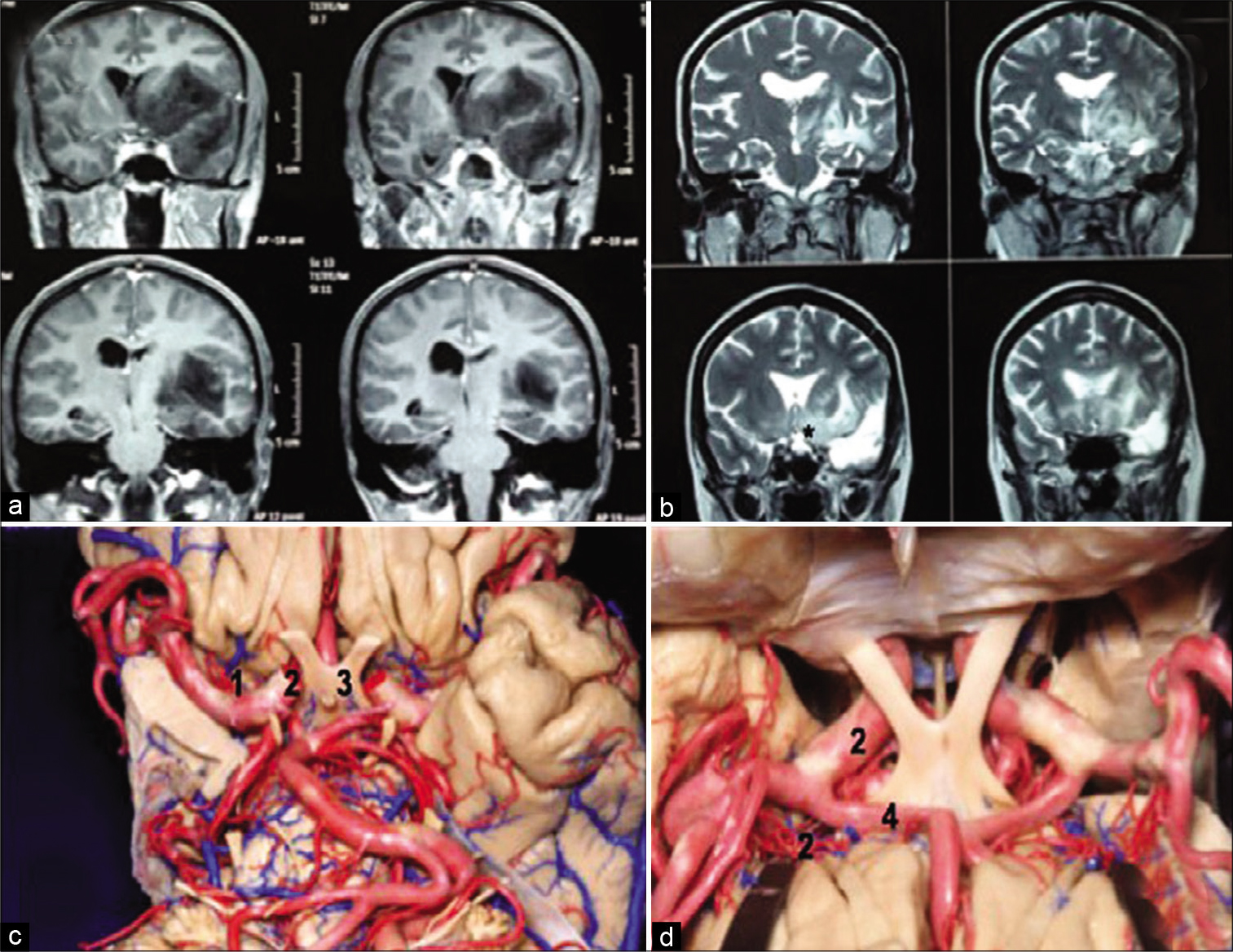
Paciente de 45 años, femenina, con crisis parciales complejas. RNM en T1 coronal (a) revelo voluminoso glioma temporo-insular con comprometimiento de la región frontal-basal al nivel de la substancia perforada anterior. Fue planeado abordaje trans-silviana con mapeo subcortical con paciente despierto y no resección del componente tumoral fronto-basal, y que puede ser visualizado en la RNM coronal en T2 posoperatoria (b). Disecciones ana- tómicas mostrando la posición de las arterias lentículo-estriadas sob visión de la base del cerebro (c) y visión superior (d). (1) Arte- rias lentículo-estriadas; (2) Arteria carótida interna; (3) Quiasma óptico; (4) Arteria cerebral anterior. En la gura inferior derecha las arterias lentículo-estriadas es- tán representadas con el número 1. Histología – Glioma grado III.
Figura 10:
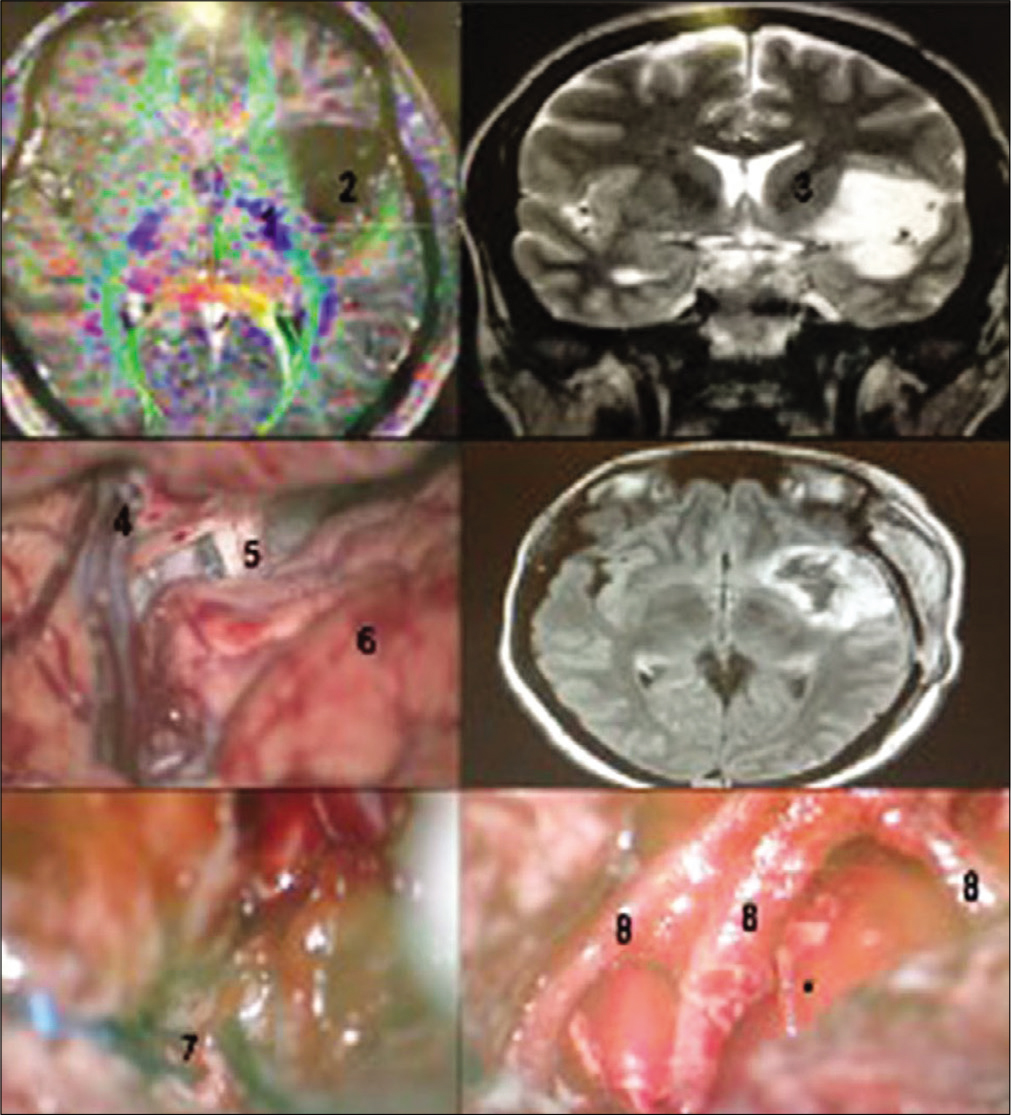
Paciente femenina de 24 años con crisis uncinadas refractarias al tra- tamiento medicamentoso. RNM T2 coronal (superior izquierda) y axial (superior derecha) evidenciando tumor insular izquierdo. Fue optado por resección micro- quirúrgica del tumor a través de abordaje trans-silviana con mapeamiento de la cortical y subcortical con paciente despierto. Imagen intraoperatoria evidencian- do amplia disección de la fisura silviana y visualización de los ramos M2 disten- dido sobre la ínsula debido al tumor (central). Ultra sonografía intraoperatoria fue útil para localizar la relación del tumor con el córtex elocuente (inferior izquier- da). Estimulador bipolar usado para mapeamiento cortical y subcortical (inferior central). RNM en FLAIR en las primeras 24 horas después a la cirugía eviden- ciando resección tumoral. Paciente sin déficits posoperatorios. Histología: Tumor neuroectodérmico primitivo (PNET). (1) Fisura silviana; (2) Rodilla de la cápsula in- terna; (3) Giro frontal inferior; (4) Ínsula; (5) Giro temporal superior.
Figura 11:
Paciente masculino de 34 años con crisis epilépticas parciales y he- miparesia progresiva con RNM coronal T2 y axial en FLAir (superior izquierda) evidenciando voluminoso glioma fronto-temporo-insular con compresión impor- tante del tronco cerebral. Realizada cirugía sob anestesia general con ultra so- nografía intraoperatoria para mapear extensión tumoral (Superior central). Como había extensión para el neocórtex fue realizada corticotomía y operculotomía del giro frontal inferior y lobectomía temporal derecha ampliada posteriormente (superior derecha). RNM 3 meses después a la cirugía en T2 coronal (inferior izquierda) y sagital (inferior derecha) revelando extensa resección de los com- ponentes neocorticais del tumor con persistencia del componente insular (as- terisco). Paciente mejoro del déficit previo en el posoperatorio inmediato, evo- lucionando de fuerza grado IV- para V. 1) Lóbulo frontal; 2) Lóbulo temporal; 3) Surgicel en la cavidad quirúrgica. Histología – Glioma grado II.
Figura 12:
Paciente femenina de 32 años con epilepsia refractaria al tratamiento medicamentoso (10 a 15 crisis parciales complejas al día sin mejora con 02 es- quemas de mono terapia y 02 de poli terapia). Historia de haber realizado biop- sia en otro servicio cuya histología revelo glioma grado II. Realizada cirugía con mapeamiento cortical y subcortical con paciente despierto con resección >90% del componente tumoral. Paciente con discreto déficit del habla (parafasia) que recupero totalmente con rehabilitación neuropsicológica y fono audiológica en 6 meses. Sin déficits motores en el posoperatorio. Sin crisis (Engel 1) después la cirugía. RNM con tracto grafía revelando relación del glioma insular (2) con la cápsula interna (1) (superior izquierda). RNM coronal T2 revelando la exacta to- pografía insular del tumor con pequeña extensión temporal (superior derecha). La disección de la fisura silviana inicia posteriormente y se extiende para la cis- terna de la base (central izquierda). RNM Flair en el posoperatorio inmediato re- velando resección tumoral (Central derecha). Estimulación subcortical para es- tablecer límite de resección medial del tumor (inferior izquierda) y ramos M2 después resección del glioma. Note el ramo perforante calibroso oriundo de la porción más posterior de un de los ramos M2 (asterisco), que en estos casos de- ben ser preservados. (3) Cápsula interna; (4) Vena silviana superficial dirigiéndose para el seno esfeno parietal; (5) Nervio óptico; (6) Lóbulo frontal; (7) Estimulador bipolar; (8) Ramos M2 de la arteria cerebral media.
Figura 13:
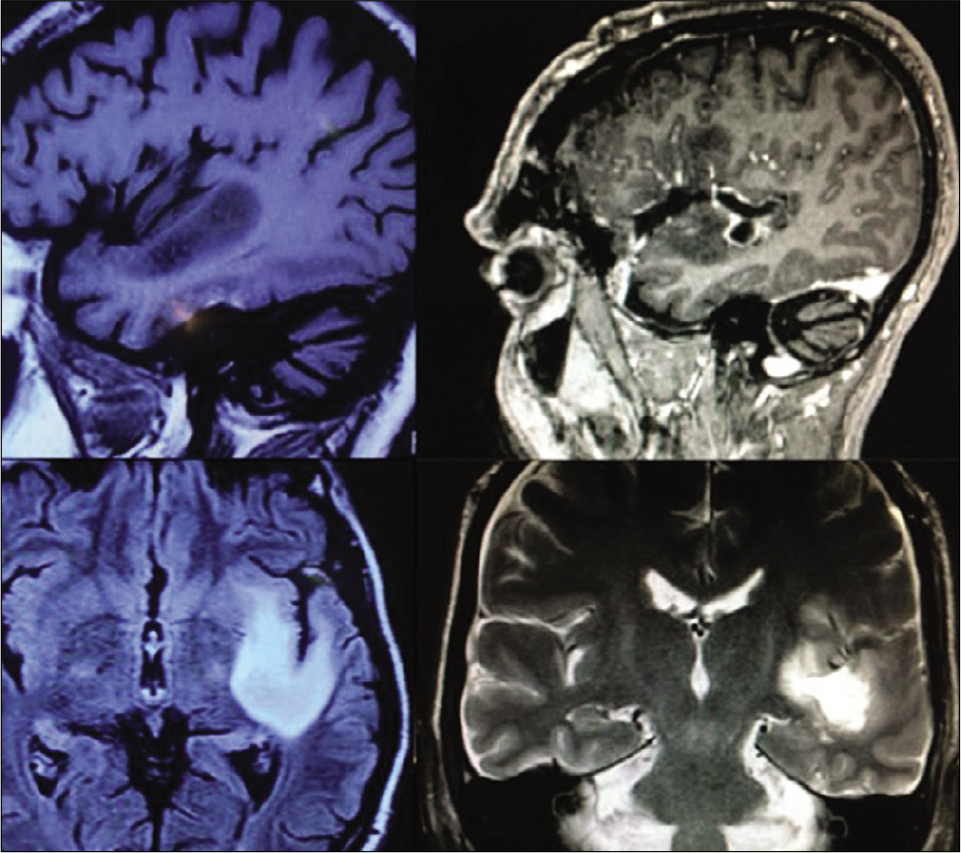
Paciente masculino de 46 años con crisis epiléptica parcial compleja. RNM T1 con gadolinio evidenciando lesión hipo intensa y sin realce por el con- traste en la región posterior de la ínsula en íntima relación con el surco circu- lar posterior de la ínsula (superior e inferior izquierda). Mismo el tumor siendo a la izquierda, pero por el hecho de estar localizado en la región más posterior de la ínsula (sin relación con el fascículo uncinado) optamos por resección tumoral con pacientes anestesiados, a través de la vía trans-silviana con resección sub- total del tumor (superior e inferior derecho). Pacientes sin déficits posoperato- rios. Histología: glioma grado II.
Figura 14:
Visión intraoperatoria del caso de la Figura 13. Después disección amplia de la fisura silviana disecase meticulosamente y separase el tronco in- ferior de M2 para que identifiquemos la parte más posterior del surco circular inferior de la ínsula (Superior izquierdo), en el cual entramos e iniciamos la re- sección tumoral (superior derecho). Las imágenes inferiores izquierda y dere- cha evidenciando la cavidad cirugía después la resección tumoral. (1) Segmen- to M1 de la ACM; (2) Vena insular; (3) Tronco superior de la ACM; (4) Tronco inferior de la ACM; (5) Aspirador quirúrgico; (6) Espátula de cerebro; (7) Tumor; (8) Vena sil- viana superficial; (9) Arteria carótida interna; (10) Nervio óptico; (11) Aspirador ul- trasónico.
Figura 15:
Paciente de 52 años con déficits cognitivos y crisis convulsiva gene- ralizada tónico-clónica. RNM con tracto grafía evidenciando lesión hiperintensa en T2 en territorio de la ínsula, pero con aspecto infiltrativo de la capsula inter- na (superior izquierda) y del fascículo uncinado (superior derecha). A tracto gra- fía fue útil en este caso, pues estando la cápsula interna con alteración de señal característica de extensión tumoral y estando el paciente sin déficit motor en el preoperatorio optamos por la estrategia de usar la estimulación subcortical en el inicio de la resección tumoral con el objetivo de evitar lesión del tracto corti- co-espinal envuelto por el tumor. Debido al padrón infiltrativo fueron realizados biopsias de varias partes del tumor y después resección parcial basado en el lí- mite dado por la estimulación subcortical. Las partes inferiores izquierda y de- recha evidencian el raciocinio intraoperatorio estableciendo la relación entre los observados anatómicos y fisiológicos intraoperatorios y la neuroimagen.
DISCUSIÓN
Presentación clínica de los gliomas de la ínsula
El principal síntoma encontrado en nuestra serie de casos fueron crisis epilépticas parciales complejas o generalizados. Otros síntomas encontrados en los gliomas insula- res de bajo grado pueden ser: déficits focales (hemipare- sia, afasia, apraxia), cefalea y apatía.
Es fundamental resaltar que gliomas insulares pueden ser asintomáticos o presentar síntomas mínimos, siendo el diagnóstico realizado durante la investigación de una cri- sis parcial compleja o misma en la investigación de sínto- mas no relacionados al tumor.
De acuerdo con Lang et al.,[
Estudio preoperatorio
El estudio detallado de las imágenes en el preoperato-rio es necesario para planear la cirugía y evitar compli- caciones durante el procedimiento.[
El abordaje quirúrgico
En los casos en que los gliomas son puramente insula- res (3A y 3B de Yaşargil), el abordaje trans-silviano es, en nuestra opinión, la técnica más adecuada y anatómica. La anatomía normal y las variaciones de vascularización de la ínsula deben ser reconocidas [
De acuerdo con Yasargil,[
Tumor y resección
El mejor tratamiento para gliomas insulares es la re- sección amplia, proporcionando aumento de la sobrevi- da libre de la enfermedad y de la calidad de vida.[
Gliomas de bajo grado permiten resecciones (nunca en bloque) más anatómicas porque tienen un plano quirúrgico mejor entre el tumor y el tejido cerebral. Gliomas de alto grado, por otro lado, debido a su hipervascularización adherida a las arterias (segmentos M2 y M3), exigen una detallada y meticulosa disección que, en muchos casos, no puede ser realizado sin causar graves secuelas. En estos casos la evaluación sobre proseguir o no con la resección debe considerarse según la experiencia de los cirujanos.
Optamos en algunos casos de glioblastoma insular rese- car el componente tumoral del lóbulo temporal y realizar resección parcial del componente insular.
En relación al armamento tecnológico utilizado en gliomas de la ínsula, consideramos fundamental el uso de aspirador ultrasónico (con potencia de aspiración nunca más de 30), monitorización neurofisiológica intraoperato- ria y microscopio quirúrgico. Ultrasonografía intraopera- toria usamos en casos seleccionados para localizar la par- te posterior del tumor y su relación con la fisura silviana. La [
La [
Recomendamos fuertemente el entrenamiento en laboratorio de microcirugía y anatomía buscando reproducir la cirugía en especímenes anatómicos cadavéricos previamente al manejo quirúrgico de los pacientes.[
De acuerdo con algunos autores,[
De acuerdo con Moshel et al.,[
Grado de resección tumoral
Los primeros estudios relativos al grado de resección de los gliomas insulares llevaron en cuenta la impresión intraoperatoria que el cirujano daba depuse del final de la resección.[
Monitorización intra operatoria
Por el motivo que la formación del neurocirujano ser basada principalmente en principios anatómicos, las técnicas de monitorización neurofisiológica intraoperatoria (MNIO) solamente comenzaron a hacer parte del armamentarium neuroquirúrgico hace poco tiempo, estan- do todavía ausentes en la grande mayoría de los centros de neurocirugía brasileros. Esta tecnología, entretanto, muestra buena correlación con el pre y posoperatorio neu- rológico de los pacientes y alerta el cirujano, en tiempo real durante la cirugía, sobre posibles déficits prevenibles. Dentro de los parámetros usados en la MNIO están los potenciales evocados motor (PEM) y somato sensorial (PESS), que son una tecnología que permite evaluar en tiempo real el status neurológico de las funciones motoras (tracto cortico– espinal) y sensitivas (tracto somato sensi- tivo) del paciente durante el período intraoperatorio, con el objetivo de reducir el riesgo de morbilidad quirúrgica. También, todos los nervios craneanos, con excepción del olfatorio, pueden ser monitoreados.
El objetivo primario de las técnicas de monitorización neurofisiológicas intraoperatorias es disminuir la morbimortalidad quirúrgica, a través del reclutamiento de información en tiempo real que reflejen el status fisiológico de las funciones del SNC.
Esto es especialmente útil en el PEM utilizado en el manejo quirúrgico de aquellas lesiones que están en ínti- ma relación con el tracto cortico-espinal, tales como tu- mores insulares, talámicos e hipotalámicos, que están re- lacionados topográficamente con la cápsula interna y la corona radiada, tumores en el área motora primaria, tu- mores en el tronco cerebral y tumores intramedulares. En estos casos, el cirujano puede actuar en tiempo real, sien- do más o menos agresivo.
Los mecanismos de lesión nerviosa pueden ser los si- guientes: tracción del tejido nervioso, directa o indirectamente, compresión, isquemia, desequilibrio electrolítico, toxicidad, variaciones de temperatura y reacciones exotérmicas por el uso de electrocauterio, trépano o dril.
Cuanto más precoz es la identificación de la alteración y más rápida es la intervención del cirujano son mayores las chances de limitarlas o hasta mismo revertirlas. Otro factor a ser considerado es que la estimulación eléctri- ca puede causar alteraciones en las señales vitales duran- te el procedimiento, como taquicardia leve consecuente al estímulo de nervios periféricos. Pueden aparecer mo- vimientos bruscos de grande amplitud de parte o de todo el miembro, los cuales pueden ser controlados con la re- ducción de la intensidad o la frecuencia de los estímulos. Un elemento crucial en el uso de potencial evocado motor es el no uso de miorrelajantes durante esta técnica. Los instrumentos más utilizados para la monitorización intra operatoria son: estimulación cortical y subcortical direc- tas para mapeamiento de las funciones corticales y sub- corticales, potencial evocado somato sensorial y potencial evocado motor.
Estimulación eléctrica trans-craneana y la estimulación bipolar subcortical son los métodos utilizados para la monitorización intraoperatoria durante la cirugía de glio- mas insulares. Recientemente, Kombos et al.[
Empíricamente, consideraron la presencia de un potencial de acción muscular compuesto después de un estí- mulo subcortical 3 mA indicando la necesidad de parar la resección del borde medial del tumor. En nuestros pa- cientes portadores de gliomas insulares tenemos usado el parámetro de 5 mA para parar la resección en la porción medial del tumor entretanto en su porción central y 7 mA en el rostro medial de la superficie postero-superior del tumor, pues sabemos que esta es la porción de los glio- mas insulares que están en contacto directo con la corona radiada. Este es un protocolo que creamos para maximi- zar la resección de la cara medial del tumor sin lesionar el tracto cortico-espinal.[
Duffau et al.,[
La cuestión de la dominancia hemisférica podría ser realizada haciendo el test de Wada en todos los pacientes (lo que no consideramos factible), o mediante RNM funcio- nal para identificar el lado de dominancia del habla. Con- siderar a todos los pacientes diestros con tumores en el hemisferio izquierdo como dominante para el lenguaje en dicho hemisferio o, como indica Duffau et al.,[
Complicaciones
Un paciente con glioma de la ínsula es considerado para cirugía por los siguientes motivos: aumento de la sobrevida, mejora de las crisis epilépticas refractarias al manejo medicamentoso, mejora de las funciones cerebrales debi- das a la reducción del efecto de masa y, no menos impor- tantes, establecimiento del diagnóstico histológico y mo- lecular del tumor. Estos beneficios, entre tanto, deben ser contra argumentados por las potenciales complicaciones de la cirugía.[
Excluyéndose complicaciones clínicas y anestésicas de todos los tipos de cirugía, la hemiparesia/hemiplejia y la afasia son las complicaciones más temidas. Actualmente con todo el conocimiento anatómico, neurofisiología in- traoperatoria y experiencia en el abordaje microquirúrgi- ca de esta compleja región del cerebro, los resultados han sido buenos, con secuelas definitivas en un número muy reducido de pacientes.
Debemos llevar en consideración que aproximadamen- te 60% de los pacientes luego de la cirugía con algún dé- ficit, principalmente cuando la resección es amplia. Es- tos déficits, normalmente, retroceden entre 24 horas y 3 meses después de la cirugía. Una importante observación con respecto de los gliomas de la ínsula que observamos en nuestros pacientes es que generalmente un área que era elocuente (por ejemplo, alteraciones del lenguaje con es- timulación cortical directa) deja de serlo en otra cirugía. Este fenómeno es atribuido a la neuroplasticidad cerebral que los gliomas, y mismo una primera cirugía, son capa- ces de estimular en los circuitos cerebrales.[
La hemiparesia puede ocurrir por tres motivos: Infar- to arterial o venoso afectando el córtex motor primario (raro, no identificamos ningún caso en nuestra serie), le- sión directa de la cápsula interna durante resección de la parte medial del tumor (tenemos 1 caso en 44 cirugías de la ínsula) o lesión de las arterias lenticuloestriadas en la.
Declaration of patient consent
The authors certify that they have obtained all appropriate patient consent.
Apoyo financiero y patrocinio
Nil.
Conflicto de interés
Ninguno para declarar.
COMENTARIO
En el presente artículo los autores describen las técnicas quirúrgicas que utilizaron para la resección de tumores que comprometen la ínsula en 34 pacientes realizando, además, el correlato anatómico.
El artículo demuestra la complejidad que presenta la ínsula, y coincido en que se requieren de un conocimiento ana- tómico profundo e idealmente de un entrenamiento previo, como describen los autores, en laboratorios de anatomía. Considero, como los autores, que los gliomas insulares deben considerarse quirúrgicos, debido a que su resección au- menta la sobrevida, mejora las crisis epilépticas refractarias y mejora las funciones cerebrales debidas a la reducción del efecto de masa. También, remarcan que deben evaluarse las posibles complicaciones como la hemiparesia/ hemiplejia y la afasia, y para reducirlas utilizaron mapeo y estimulación subcortical, y en algunos casos realizaron resecciones con paciente despierto.
Felicito a los autores y agradezco que compartan su experiencia y conocimiento con la comunidad, demuestra un cla- ro conocimiento de esta compleja región.
Romina Argañaraz
Hospital de Pediatría Juan P. Garrahan. C.A.B.A., Buenos
Aires, Argentina
COMENTARIO
En esta segunda entrega (Parte 2) acerca del “Lóbulo de la ínsula”, los autores nos ofrecen un trabajo de correlación clínico-quirúrgica a través de su ilustración, con datos de 44 cirugías realizadas en 35 pacientes portadores de algún tipo de tumor con compromiso insular, en su mayoría gliomas.
Como se lo advierte, este reporte no incluye un análisis sistematizado de la serie, sino que toma elementos representa- tivos de la misma para ejemplificación de la toma de decisiones en vínculo a su correlato anatómico, y en relación al es- tado actual de los conocimientos provistos por la ciencia, quedando pendiente su ponderación para una futura comu- nicación.
Es así como se aporta a nivel discursivo - y en relación también a lo propuesto por otros autores - consideraciones acer- ca de la presentación clínica de los gliomas insulares, estudios preoperatorios, abordajes quirúrgicos, grado de resec- ción tumoral, monitoreo intraoperatorio y complicaciones.
Tal vez la mayor fortaleza de esta presentación sea colocar en un lugar de mayor visión y jerarquía a este lóbulo históricamente “olvidado” por las neurociencias, reconociendo su real importancia y participación en funciones cognitivas, emocionales, procesamiento del dolor, control vegetativo, percepción gustativa y lenguaje entre otras; como lo propo- nen y demuestran múltiples reportes realizados en la última década.
En congruencia con lo antes expuesto, y como bien los autores supieron reivindicar, resulta entonces de sustancial im- portancia - además de un acabado reconocimiento anatómico - el monitoreo electrofisiológico intraoperatorio, aún con pacientes despiertos en lesiones con asiento en hemisferio dominante, para la preservación de la integridad funcional de la región.
Felicitamos a los autores por la robustez conceptual de esta comunicación, quedando a la espera de una próxima entrega, donde se analicen sistemáticamente los datos de tan importante muestra.
Claudio Centurión.
Sanatorio Aconcagua. Córdoba, Argentina.
COMENTARIO
Los autores comunican su experiencia basada en 44 cirugías de tumores insulares en 35 pacientes; se muestran casos ilustrativos y se describe la técnica quirúrgica clásicamente conocida. Los datos y la metodología utilizada para la realización de esta comunicación no permiten evaluar resultados ni obtener conclusiones.
Nuestro aporte en calidad de Comentador/a es que en nuestra experiencia al igual que la de los numerosos autores que han publicado sobre este tema en las últimas dos décadas, y que son fácilmente accesibles en la literatura médica, los tumores de la ínsula se abordan con los mismos criterios de cualquier otra área elocuente del cerebro; o sea máxima resección tumoral más preservación funcional; objetivos que se logran con conocimiento de la microanatomía funcio- nal, entrenamiento y actuando dentro del marco de seguridad que brinda la tecnología.[ 1 , 2 ]
Alejandra T. Rabadán
Instituto de Investigaciones Médicas A. Lanari. Universidad de
Buenos Aires U.B.A. C.A.B.A., Argentina.
References
1. Beez T, Boge K, Wager M, Whittle I, Fontaine D, Spena G. Tolerance of awake surgery for glioma: A prospective European low-grade glioma network multicenter study. Acta Neurochir (Wien). 2013. 155: 1301-8
2. Bertani G, Fava E, Casaceli G, Carrabba G, Casarotti A, Papagno C. Intraoperative mapping and monitoring of brain functions for the resection of low-grade gliomas: Technical considerations. Neurosurg Focus. 2009. 27: E4
3. Claus EB, Horlacher A, Hsu L, Schwartz RB, Dello-Iacono D, Talos F. Survival rates in patients with low-grade glioma after intraoperative magnetic resonance image guidance. Cancer. 2005. 103: 1227-33
4. Duffau H, Capelle L, Lopes M, Bitar A, Sichez JP, van Effenterre R. Medically intractable epilepsy from insular low-grade gliomas: Improvement after an extended lesionectomy. Acta Neurochir (Wien). 2002. 144: 563-72
5. Duffau H, Capelle L, Lopes M, Faillot T, Sichez JP, Fohanno D. The insular lobe: Physiopathological and surgical considerations. Neurosurgery. 2000. 47: 801-10
6. Duffau H, Capelle L, Sichez N, Denvil D, Lopes M, Sichez JP. Intraoperative mapping of the subcortical language pathways using direct stimulations. An anatomo-functional study. Brain. 2002. 125: 199-214
7. Duffau H, Denvil D, Capelle L. Absence of movement disorders after surgical resection of glioma invading the right striatum. J Neurosurg. 2002. 97: 363-9
8. Duffau H, Mandonnet E. The onco-functional balance in surgery for diffuse low-grade glioma: Integrating the extent of resection with quality of life. Acta Neurochir (Wien). 2013. 155: 951-7
9. Duffau H, Moritz-Gasser S, Gatignol P. Functional outcome after language mapping for insular World Health Organization Grade II gliomas in the dominant hemisphere: Experience with 24 patients. Neurosurg Focus. 2009. 27: E7
10. Duffau H. A personal consecutive series of surgically treated 51 cases of insular WHO Grade II glioma: Advances and limitations. J Neurosurg. 2009. 110: 696-708
11. Duffau H. Diffuse low-grade gliomas and neuroplasticity. Diagn Interv Imaging. 2014. 95: 945-55
12. Duffau H. Surgical neurooncology is a brain networks surgery: A connectomic perspective. World Neurosurg. 2014. 82: e405-7
13. Duffau H. The conceptual limitation to relying on intraoperative magnetic resonance imaging in glioma surgery. World Neurosurg. 2014. 82: 601-3
14. Duffau H. The dangers of magnetic resonance imaging diffusion tensor tractography in brain surgery. World Neurosurg. 2014. 81: 56-8
15. Ebeling U, Kothbauer K. Circumscribed low-grade astrocytoma’s in the dominant opercular and insular region: A pilot study. Acta Neurochir (Wien). 1995. 132: 66-74
16. Fernández-Miranda JC, de Oliveira E, Rubino PA, Wen HT, Rhoton AL. Microvascular anatomy of the medial temporal region: Part 1: Its application to arteriovenous malformation surgery. Neurosurgery. 2010. 67: ons237-76
17. Gil Robles S, Gatignol P, Capelle L, Mitchell MC, Duffau H. The role of dominant striatum in language: A study using intraoperative electrical stimulations. J Neurol Neurosurg Psychiatry. 2005. 76: 940-6
18. Guenot M, Isnard J, Sindou M. Surgical anatomy of the insula. Adv Tech Stand Neurosurg. 2004. 29: 265-88
19. Hentschel SJ, Lang FF. Surgical resection of intrinsic insular tumors. Neurosurgery. 2005. 57: 176-83
20. Isnard J, Guénot M, Ostrowsky K, Sindou M, Mauguière F. The role of the insular cortex in temporal lobe epilepsy. Ann Neurol. 2000. 48: 614-23
21. Isolan G, Antunes AC, Dini LI, Stefani MA, Costa CR, Frizon L. Insular gliomas-General aspects. J Bras Neurocir. 2008. 19: 7-13
22. Isolan GR, Bianchin MM, Bragatti JA, Torres C, Schwartsmann G. Musical hallucinations following insular glioma resection. Neurosurg Focus. 2010. 28: E9
23. Isolan GR, de Aguiar PH, Aires R, Meister CS, Stefani MA. Middle cerebral artery pseudotetrafurcation: Anatomic report and review of middle cerebral artery variations. Neurosurg Q. 2010. 20: 284-7
24. Isolan GR, de Aguiar PH, Tahara A, Antunes AC, Isolan GR, de Aguiar PH.editors. Arteria carótida externa e seus ramos-anatomia microcirúrgica. Tratamento Neurocirúrgico das Doenças Vasculares do SNC. São Paulo: Di Livros; 2012. p. 1-12
25. Isolan GR, de Aguiar PH, Tahara A, Antunes AC, Isolan GR, de Aguiar PH.editors. Artérias infratentoriais-anatomia microcirúrgica. Tratamento Neurocirúrgico das Doenças Vasculares do SNC. São Paulo: Di Livros; 2012. p. 35-44
26. Isolan GR, de Aguiar PH, Tahara A, Antunes AC, Isolan GR, de Aguiar PH.editors. Artérias supratentoriais-anatomia microcirúrgica. Tratamento Neurocirúrgico das Doenças Vasculares do SNC. São Paulo: Di Livros; 2012. p. 13-34
27. Isolan GR, de Oliveira E, Recalde R. Microanatomical study of the choroidal fissure in ventricular and cisternal approaches. Arq Neuropsiquiatr. 2005. 63: 801-6
28. Isolan GR, Pereira AH, de Aguiar PH, Antunes AC, Mousquer JP, Pierobon MR. Microsurgical anatomy of the infratentorial arteries. An Anaglyphic Three-Dimensional Stereoscopic Printing Study. J Vasc Bras. 2012. 11: 114-22
29. Isolan GR, Pereira AH, de Aguiar PH, Antunes AC, Mousquer JP, Pierobon MR. Microsurgical anatomy of the supratentorial arteries. An Anaglyphic Three-Dimensional Stereoscopic Printing Study. J Vasc Bras. 2012. 11: 3-11
30. Isolan GR. The young neurosurgeon learning curve: Ethical, scientific, philosophical aspects and the importance of the microsurgical laboratory training. J Bras Neurocir. 2009. 20: 314-34
31. Ius T, Pauletto G, Isola M, Gregoraci G, Budai R, Lettieri C. Surgery for insular low-grade glioma: Predictors of postoperative seizure outcome. J Neurosurg. 2014. 120: 12-23
32. Iwasaki M, Kumabe T, Saito R, Kanamori M, Yamashita Y, Sonoda Y. Preservation of the long insular artery to prevent postoperative motor deficits after resection of insuloopercular glioma: Technical case reports. Neurol Med Chir (Tokyo). 2014. 54: 321-6
33. Kalani MY, Kalani MA, Gwinn R, Keogh B, Tse VC. Embryological development of the human insula and its implications for the spread and resection of insular gliomas. Neurosurg Focus. 2009. 27: E2
34. Karnofsky D, Burchenal JH, MacLeod CM.editors. The clinical evaluation of chemotherapeutic agents in cancer. Evaluation of Chemotherapeutic Agents. New York: Columbia University Press; 1949. p. 191-205
35. Kawaguchi T, Kumabe T, Saito R, Kanamori M, Iwasaki M, Yamashita Y. Practical surgical indicators to identify candidates for radical resection of insulo-opercular gliomas. J Neurosurg. 2014. 121: 1124-32
36. Keles GE, Lamborn KR, Berger MS. Low-grade hemispheric gliomas in adults: A critical review of extent of resection as a factor influencing outcome. J Neurosurg. 2001. 95: 735-45
37. Kombos T, Süss O, Vajkoczy P. Subcortical mapping and monitoring during insular tumor surgery. Neurosurg Focus. 2009. 27: E5
38. Krayenbühl N, Isolan GR, Hafez A, Yaşargil MG. The relationship of the fronto-temporal branches of the facial nerve to the fascias of the temporal region: A literature review applied to practical anatomical dissection. Neurosurg Rev. 2007. 30: 8-15
39. Lang FF, Olansen NE, DeMonte F, Gokaslan ZL, Holland EC, Kalhorn C. Surgical resection of intrinsic insular tumors: Complication avoidance. J Neurosurg. 2001. 95: 638-50
40. Mandonnet E, Capelle L, Duffau H. Extension of paralimbic low grade gliomas: Toward an anatomical classification based on white matter invasion patterns. J Neurooncol. 2006. 78: 179-85
41. Mandonnet E, Delattre JY, Tanguy ML, Swanson KR, Carpentier AF, Duffau H. Continuous growth of mean tumor diameter in a subset of Grade II gliomas. Ann Neurol. 2003. 53: 524-8
42. Moshel YA, Marcus JD, Parker EC, Kelly PJ. Resection of insular gliomas: The importance of lenticulostriate artery position. J Neurosurg. 2008. 109: 825-34
43. Neuloh G, Pechstein U, Schramm J. Motor tract monitoring during insular glioma surgery. J Neurosurg. 2007. 106: 582-92
44. Ojemann GA, Whitaker HA. Language localization and variability. Brain Lang. 1978. 6: 239-60
45. Oldfield RC. The assessment and analysis of handedness: The Edinburgh inventory. Neuropsychologia. 1971. 9: 97-113
46. Ribas GC, Bento RF, Rodrigues AJ. Anaglyphic three-dimensional stereoscopic printing: Revival of an old method for anatomical and surgical teaching and reporting. J Neurosurg. 2001. 95: 1057-66
47. Ribas GC, de Oliveira E. The insula and the central core concept. Arq Neuropsiquiatr. 2007. 65: 92-100
48. Ribas GC, Yasuda A, Ribas EC, Nishikuni K, Rodrigues AJ. Surgical anatomy of microneurosurgical sulcal key points. Neurosurgery. 2006. 59: ONS177-210
49. Robles SG, Gatignol P, Lehéricy S, Duffau H. Long-term brain plasticity allowing a multistage surgical approach to World Health Organization Grade II gliomas in eloquent areas. J Neurosurg. 2008. 109: 615-24
50. Roper SN, Lévesque MF, Sutherling WW, Engel J. Surgical treatment of partial epilepsy arising from the insular cortex. Report of two cases. J Neurosurg. 1993. 79: 266-9
51. Sanai N, Polley MY, Berger MS. Insular glioma resection: Assessment of patient morbidity, survival, and tumor progression. J Neurosurg. 2010. 112: 1-9
52. Simon M, Neuloh G, von Lehe M, Meyer B, Schramm J. Insular gliomas: The case for surgical management. J Neurosurg. 2009. 110: 685-95
53. Stummer W, Pichlmeier U, Meinel T, Wiestler OD, Zanella F, Reulen HJ. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: A randomised controlled multicentre Phase III trial. Lancet Oncol. 2006. 7: 392-401
54. Taillandier L, Duffau H. Epilepsy and insular Grade II gliomas: An interdisciplinary point of view from a retrospective monocentric series of 46 cases. Neurosurg Focus. 2009. 27: E8
55. Tanriover N, Rhoton AL, Kawashima M, Ulm AJ, Yasuda A. Microsurgical anatomy of the insula and the sylvian fissure. J Neurosurg. 2004. 100: 891-922
56. Türe U, Yaşargil DC, Al-Mefty O, Yaşargil MG. Topographic anatomy of the insular region. J Neurosurg. 1999. 90: 720-33
57. Türe U, Yaşargil MG, Al-Mefty O, Yaşargil DC. Arteries of the insula. J Neurosurg. 2000. 92: 676-87
58. Vanaclocha V, Sáiz-Sapena N, García-Casasola C. Surgical treatment of insular gliomas. Acta Neurochir (Wien). 1997. 139: 1126-34
59. Wen HT, Rhoton AL, de Oliveira E, Cardoso AC, Tedeschi H, Baccanelli M. Microsurgical anatomy of the temporal lobe: Part 1: Mesial temporal lobe anatomy and its vascular relationships as applied to amygdalohippocampectomy. Neurosurgery. 1999. 45: 549-91
60. Wen HT, Rhoton AL, de Oliveira E, Castro LH, Figueiredo EG, Teixeira MJ. Microsurgical anatomy of the temporal lobe: Part 2-sylvian fissure region and its clinical application. Neurosurgery. 2009. 65: 1-35
61. Wolf BS, Huang YP. The insula and deep middle cerebral venous drainage system: Normal anatomy and angiography. Am J Roentgenol Radium Ther Nucl Med. 1963. 90: 472-89
62. Yasargil MG, Krisht AF, Türe U, Al-Mefty O, Yaşargil DC. Microsurgery of insular gliomas: Part II-opening of the sylvian fissure. Contemp Neurosurg. 2002. 24: 1-5
63. Yasargil MG, Krisht AF, Türe U, Al-Mefty O, Yaşargil DC. Microsurgery of insular gliomas: Part III-pathophysiology and clinical presentation. Contemp Neurosurg. 2002. 24: 1-5
64. Yasargil MG, Krisht AF, Türe U, Al-Mefty O, Yaşargil DC. Microsurgery of insular gliomas: Part IV-surgical treatment and outcome. Contemp Neurosurg. 2002. 24: 1-8
65. Yaşargil MG, von Ammon K, Cavazos E, Doczi T, Reeves JD, Roth P. Tumours of the limbic and paralimbic systems. Acta Neurochir (Wien). 1992. 118: 40-52
66. Yasargil MG.editors. Microneurosurgery. New York: Thieme Medical; 1996. Vol 4:
67. Zentner J, Meyer B, Stangl A, Schramm J. Intrinsic tumors of the insula: A prospective surgical study of 30 patients. J Neurosurg. 1996. 85: 263-71