- Department of Neurosurgery, Hospital Nacional Guillermo Almenara, Lima, Peru,
- Department of Medicine, School of Biomedical Sciences, Austral University, Mariano Acosta, Buenos Aires, Argentina.
Correspondence Address:
Jafeth Lizana, Department of Neurosurgery, Hospital Nacional Guillermo Almenara, Lima, Peru.
DOI:10.25259/SNI_676_2021
Copyright: © 2021 Surgical Neurology International This is an open-access article distributed under the terms of the Creative Commons Attribution-Non Commercial-Share Alike 4.0 License, which allows others to remix, tweak, and build upon the work non-commercially, as long as the author is credited and the new creations are licensed under the identical terms.How to cite this article: Jafeth Lizana1, Nelida Aliaga2, Alfonso Basurco1. Hematoma subdural crónico: Una patología común de manejo complejo. 09-Aug-2021;12:
How to cite this URL: Jafeth Lizana1, Nelida Aliaga2, Alfonso Basurco1. Hematoma subdural crónico: Una patología común de manejo complejo. 09-Aug-2021;12:. Available from: https://surgicalneurologyint.com/surgicalint-articles/11024/
Abstract
Antecedentes: El hematoma subdural crónico (HSDC) es una patología ampliamente estudiada, muy frecuente, sobre todo en adultos mayores; su cuadro clínico tiene una apariencia benigna y suele ir acompañado de múltiples comorbilidades asociadas a la edad, lo que resulta en un aumento de las complicaciones e incluso la muerte. Con el incremento de la expectativa de vida a nivel mundial, el uso de medicamentos antitrombóticos es cada vez más frecuente. El papel de estos fármacos en la evolución de la enfermedad como en la recurrencia, sigue siendo motivo de discusión.
Métodos: Los autores revisaron la fisiopatología y características clínicas del HSDC. El presente artículo discute acerca de las terapéuticas actuales y las nuevas opciones de tratamiento que podrían mejorar los resultados. Este manuscrito es susceptible de cambios en el tiempo, con el desarrollo científico y tecnológico.
Resultados: El HSDC puede ser abordado por vía quirúrgica y farmacológica; no obstante, un manejo individualizado requiere la consideracion cuidadosa de diversos factores. A pesar de los avances en el campo de la neurocirugía, la clásica trepanación craneal sigue siendo el Gold estándar en el HSDC y sobre todo en pacientes con síntomas graves. Se debe resaltar que aún hay aspectos de este procedimiento (como la localización del dren, número de drenajes, el efecto de la irrigación, la temperatura de la solución con que se irriga, etc.) que siguen siendo materia de estudio.
Conclusiones: Entender el mecanismo de la enfermedad ha permitido explicar su historia natural y a su vez proponer nuevas alternativas de tratamiento. El manejo médico (atorvastatina, corticoides) ha generado gran interés por sus alentadores resultados preliminares. Recientemente, se ha reportado la terapia endovascular como una alternativa segura y existe gran expectativa por confirmar su efecto en estudios más grandes.
Keywords: Anticoagulación, Atorvastatina, Embolización, Hematoma subdural crónico, Recurrencia
INTRODUCCIÓN
El hematoma subdural crónico está definido como una colección de sangre, con restos de su degradación, localizados en el espacio subdural.[
Los factores etiológicos asociados a la formación de HSDC son: la ruptura de venas puente (en la mayoría de casos); desgarro de aracnoides con la subsecuente formación de un higroma; fragilidad de neo vasos provenientes de la arteria meníngea media y la lesión de vasos piales.[
La cirugía (trepanación) actualmente es el tratamiento de elección; sin embargo, la recurrencia continúa siendo su principal problema.[
ALCANCE DEL PROBLEMA
Según datos del Instituto Nacional de Estadística e Informática (INEI) de Perú, la cantidad de adultos mayores en nuestro país ascendía a 3.3 millones en el año 2018 (10.4% de la población total); dos años más tarde, en 2020, se modificó a 4.1 millones de adultos mayores (12.7% de la población general).[
Los HSDC están íntimamente asociados a la edad. Su incidencia en menores de 65 años es de 3,4 por cada 100.000 habitantes, mientras que en mayores de 65 años va de 8 a más de 50 por cada 100.000 habitantes y en mayores de 80 años su incidencia puede llegar a más de 120 por cada 100.000 habitantes.[
A pesar de ser una patología con un manejo quirúrgico relativamente sencillo, está lejos de ser benigna.[
ETIOLOGÍA
El 80% de los HSDC están asociados a un evento traumático craneal, los factores etiológicos responsables de la formación del HSDC son: la ruptura de venas puente por trauma leve, sangrado espontáneo, secundario a hematoma subdural agudo; desgarro de aracnoides y formación de un higroma; fragilidad de los neovasos provenientes de la arteria meníngea media (aproximadamente 1/3 de los casos) y lesión de vasos piales.[
Estos eventos condicionan un sangrado recurrente (que se expande por presión osmótica) promovido por la angiogénesis y la inflamación, favoreciendo la exudación, micro sangrados y coagulopatía; todo delimitado en el micro ambiente formado por las membranas.[
Las denominaciones de subdural agudo y crónico nos dan la idea de un continuo. Si bien algunos hematomas subdurales agudos pueden evolucionar a HSDC, esto se observa en menos del 3 o 5% de los pacientes.[
Otro factor para considerar es el tiempo de resolución; mientras el hematoma subdural agudo se resuelve en 4 a 6 semanas, el higroma puede persistir más de 3 meses. Sin embargo, es posible que ambas estén a la par en frecuencia como etiología, debido a la mayor prevalencia de hematomas subdurales agudos con respecto a los higromas subdurales.[
FISIOPATOLOGÍA
La microestructura de las membranas del HSDC son importantes en el desarrollo de la enfermedad.[
La membrana interna tiene 4 capas: la capa externa de la superficie del hematoma; la capa intermedia rica en eosinófilos; una capa de la superficie aracnoidea con pigmentos hemáticos, fibrina, colágeno y, finalmente, la capa del complejo aracnoideo formado por células aracnoideas con escasos desmosomas, entremezcladas con fibras de colágeno y microfilamentos.[
Varios estudios han hallado en los HSDC un incremento local en las concentraciones de citocinas pro inflamatorias como el TNF α, IL-1, IL-6, e IL-8.[
Los eosinófilos son característicos en las membranas del HSDC.[
El factor de crecimiento derivado del endotelio vascular (VEGF) está incrementado en los neovasos de la membrana externa de los HSDC; además, su concentración es mayor en presencia de membranas que en ausencia de éstas.[
Se ha observado que la forma del cráneo puede relacionarse al desarrollo de higromas y sugerirnos el origen del HSDC.[
CLASIFICACIÓN
Existen varias clasificaciones del HSDC. En 1981 Markwalder et al. propusieron una clasificación para los pacientes con HSDC considerando la parte clínica y los estratificaron en 5 grupos del 0 al 4 como se muestra en la
Table 1:
Clasificación de Markwalder[
En el 2001 Nakaguchi et al., describieron un esquema de clasificación en base a la apariencia tomográfica [
Table 2:
Clasificación de Nakaguchi[
Posteriormente en 2017 Stanišić and Pripp desarrollaron el sistema de grados de Oslo para predecir recurrencia en los post-operados de HSDC en base a la clasificación de Nakaguchi, el volumen del HSDC y el volumen residual en el postoperatorio. Dando puntaje a cada ítem, la suma total de éstos nos da valores del 0 al 5 [
Table 3:
Sistema de Grados de Oslo del HSDC[
FACTORES DE RIESGO
El hematoma subdural crónico es una enfermedad que posee múltiples factores de riesgo, entre ellos, la edad avanzada como una de las más frecuentes. Esto podría deberse a la mayor atrofia cerebral y también un mayor riesgo de caídas en adultos mayores.[
DIAGNÓSTICO POR IMÁGENES
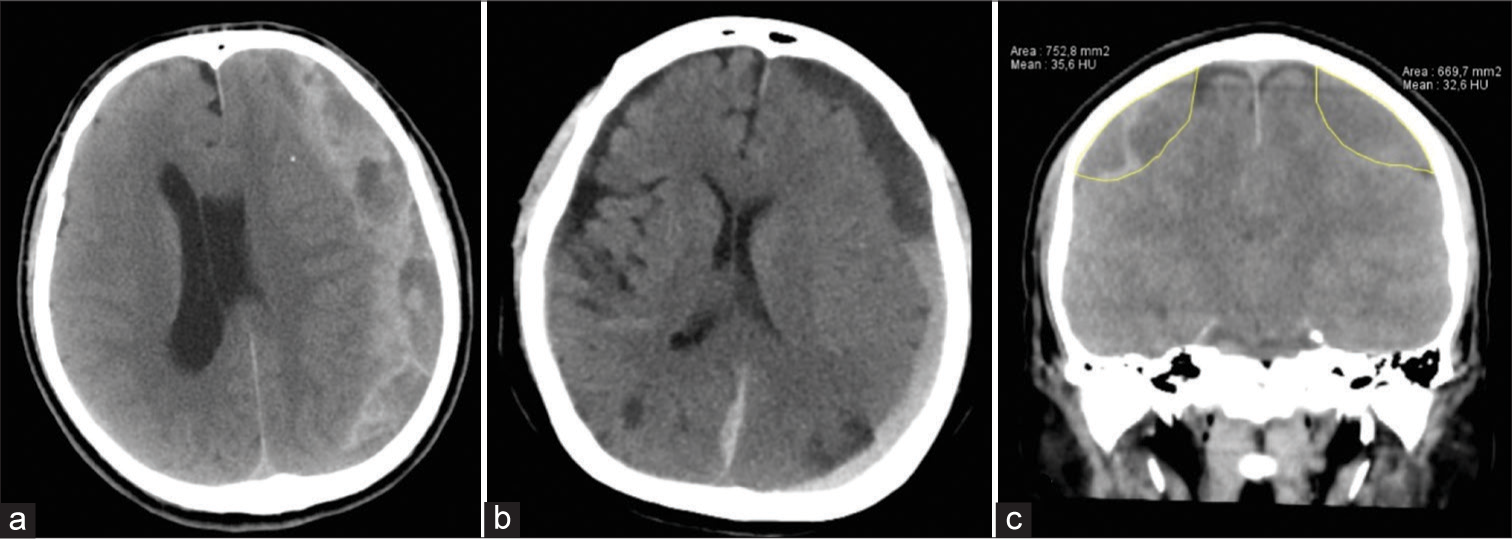
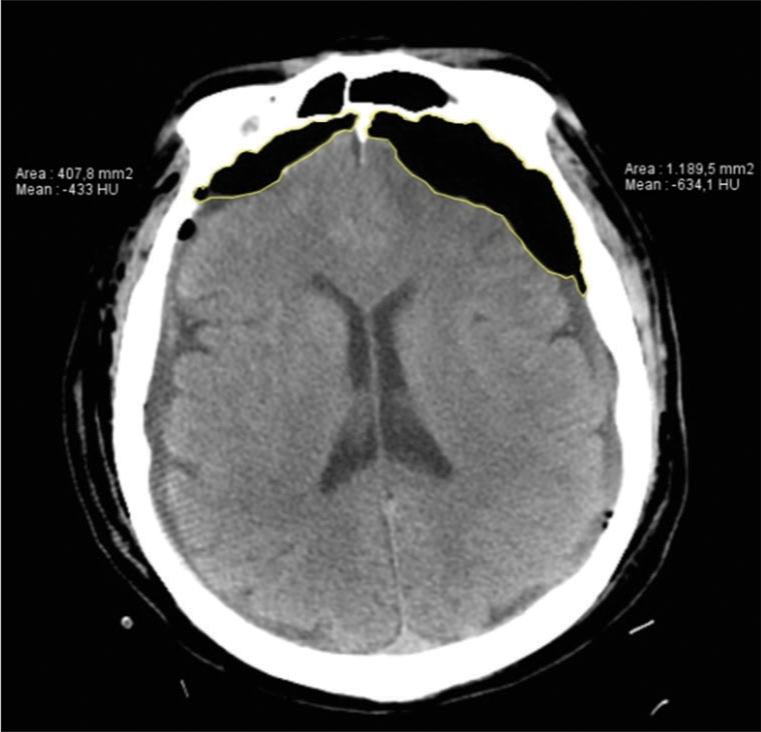
El HSDC generalmente se diagnostica mediante tomografía computarizada. Pueden ser hipodensos, isodensas o de densidad heterogénea y su forma suele ser cóncavoconvexa.[
La cuantificación del volumen del HSDC ha variado en el tiempo. Uno de los métodos más conocidos es el AxBxC/2 que proviene del cálculo del volumen de un elipsoide (4/3π(A/2XB/2xC/2)).[
RECURRENCIA
La definición de recurrencia es un tema de discusión; sin embargo, hay concordancia al considerar la reaparición de los síntomas y del hematoma dentro de la cavidad operada.[
Uno de los factores de riesgo conocidos para recurrencia post-operatoria es el pneumoencéfalo residual.[
Debido al rol del pneumoencéfalo en la recurrencia se ha reportado la aspiración quirúrgica de éste con la finalidad de reducir su volumen.[
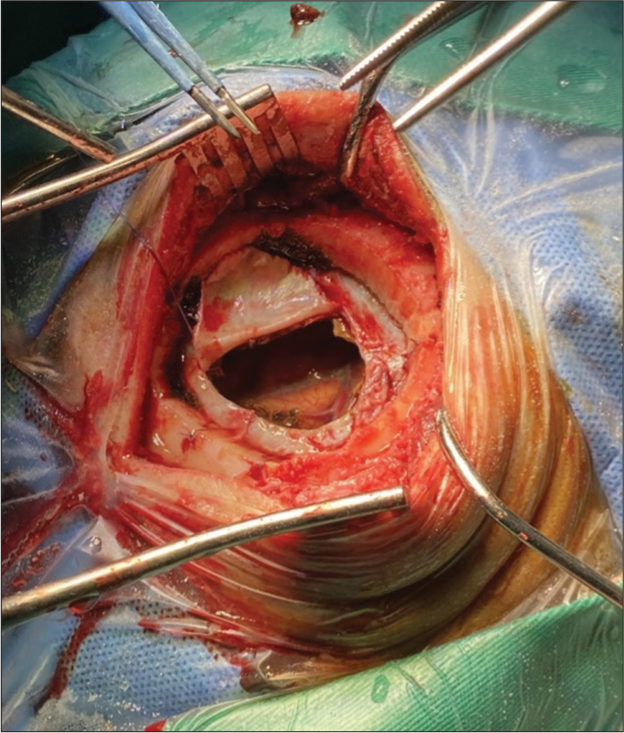
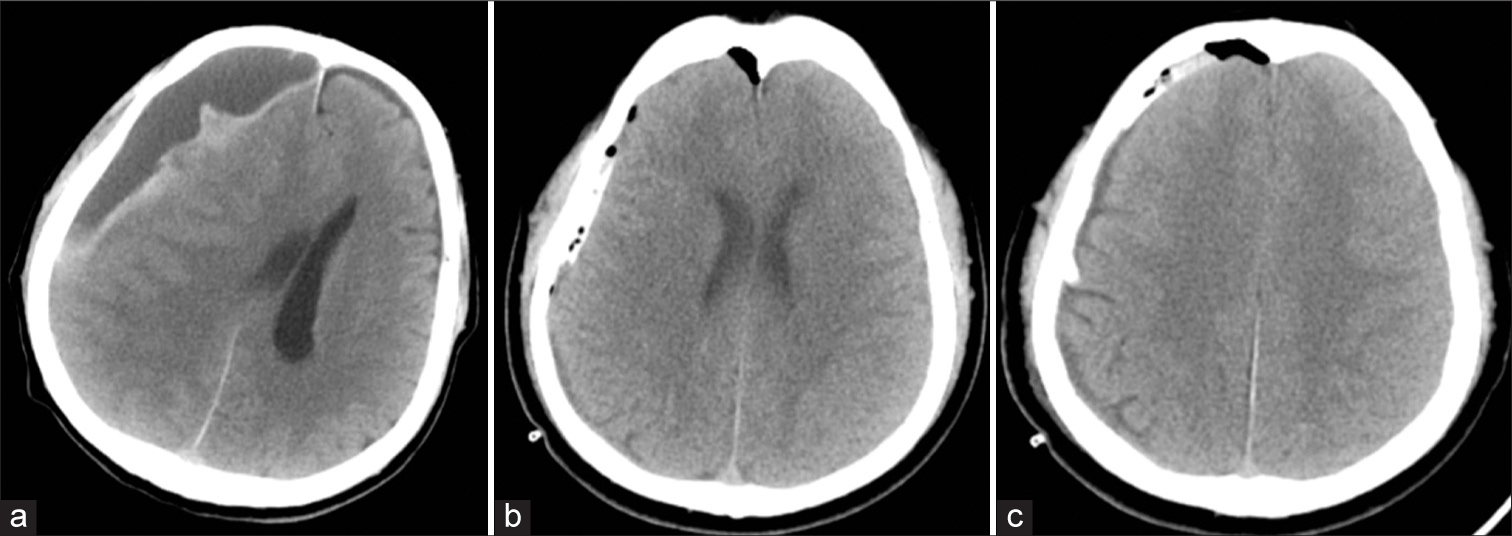
TRATAMIENTO QUIRÚRGICO
El tratamiento quirúrgico sigue siendo considerado actualmente el ¨Gold Standard¨ por la rápida mejora de los pacientes, su simplicidad, pocos riesgos, bajos costos y corta estancia post quirúrgica.[
CONTROVERSIAS DE LA CIRUGÍA
En las revisiones sistemáticas sobre el manejo quirúrgico las trepanaciones por burr hole o twist drill tienen menor riesgo de morbilidad y mortalidad comparadas con la craneotomía, pero esta última tiene ventajas en cuanto a la recidiva de la enfermedad.[
La irrigación del hematoma durante la cirugía puede favorecer el ingreso de aire (pneumoencéfalo) e impedir la adecuada re-expansión del cerebro.[
La colocación de un drenaje durante la cirugía del HSDC ha demostrado disminuir significativamente la recurrencia en varios estudios prospectivos. Sin embargo, en casos donde la re-expansión del parénquima cerebral limite su colocación podría predisponer a complicaciones.[
Según lo revisado, hay poca evidencia que sustente la posición del drenaje en el espacio subdural y podría implicar riesgos por mal posición (hematomas o injurias parenquimales).[
Existen estudios con resultados discrepantes respecto al número de burr hole a realizar, pero al momento no hay evidencia contundente a favor del uso de 2 burr hole comparado a la realización de uno.[
COMPLICACIONES DE LA CIRUGÍA
El manejo quirúrgico, como todo procedimiento, tiene riesgos y potenciales complicaciones; además, la mayoría de los pacientes con HSDC son adultos mayores con comorbilidades. Las posibles complicaciones más frecuentes de la cirugía son: recurrencia del hematoma, hematoma epidural, hematoma intracerebral por descompresión, crisis epiléptica, edema cerebral, mal posición del dren, infección y pneumoencéfalo a tensión.[
El hematoma subdural agudo como complicación ocurre en alrededor del 2% de pacientes; son más raras aún el pneumoencéfalo a tensión y el empiema subdural.[
Las complicaciones hemorrágicas del HSDC son infrecuentes (0.2–0.4%). Se han descripto casos de HSA no aneurismática, hemorragias talámicas, cerebrales lobares y cerebelosas; generalmente son atribuidas a la descompresión rápida del hematoma.[
TRATAMIENTO MÉDICO
Atorvastatina
El tratamiento médico ha tomado relevancia con el uso de los corticoides y la atorvastatina. Esta última, a bajas dosis, parece promover una adecuada angiogénesis en la membrana externa del HSDC, favoreciendo la maduración de sus vasos y evitando el crecimiento de estos hematomas.[
La atorvastatina se indica generalmente en pacientes considerados de alto riesgo como hipertensos, diabéticos, HSDC bilaterales y añosos.[
A pesar de los resultados reportados, un ensayo clínico randomizado que evaluó el efecto de la atorvastatina como tratamiento primario evidenció que el 11.2% requirió cirugía por deterioro neurológico y/o por crecimiento del hematoma.[
Por lo anterior, la atorvastatina es una herramienta de gran interés en el manejo de esta patología; sin embargo, se debe considerar que uno de los puntos débiles de un ensayo clínico fue la poca reducción del volumen del hematoma a pesar del tiempo largo de tratamiento.[
CORTICOIDES
Los corticoides parecen tener un lugar en el tratamiento conservador de los HSDC debido a su efecto antiinflamatorio, disminuyendo las citocinas, enzimas pro inflamatorias, óxido nítrico y VEGF.[
Existen pocos estudios prospectivos que evalúen los corticoides como tratamiento primario o coadyuvante del HSDC. Se encuentran en curso varios ensayos clínicos randomizados que se espera brinden mayor información para esclarecer su rol en el manejo de esta patología y estandarizar las indicaciones.[
ÁCIDO TRANEXÁMICO
El ácido tranexámico es un inhibidor de la conversión de plasminógeno en plasmina, ligándose a los sitios de lisina, por tanto es un medicamento antifibrinolítico e inhibidor del sistema de la kalicreína.[
Las contraindicaciones para el uso de este medicamento son amplias: enfermedades cardiovasculares que requieran antiagregación o anticoagulación, historia de evento trombótico en el último año, portadores de dispositivos vasculares, otras enfermedades que predispongan a la trombosis, cirugía cardíaca o vascular en los últimos 6 meses, uso de otros medicamentos pro trombótico, hipersensibilidad, embarazo o lactancia.[
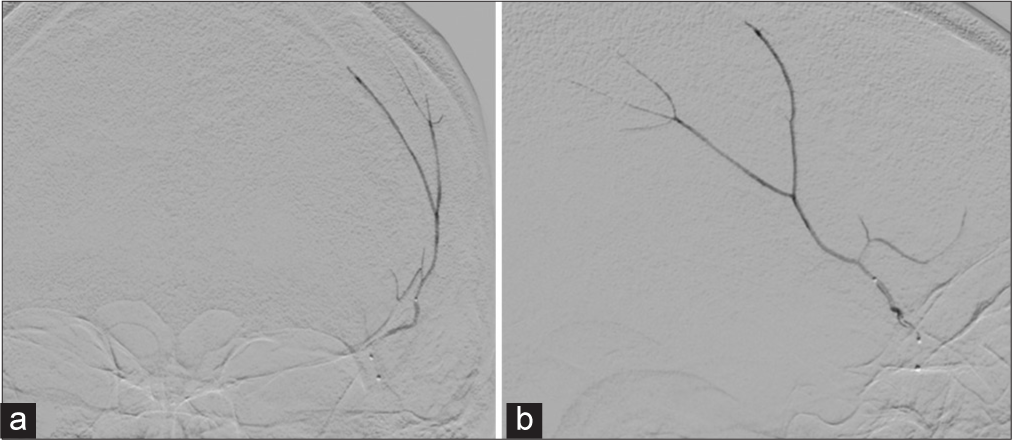
TRATAMIENTO ENDOVASCULAR
Fundamento
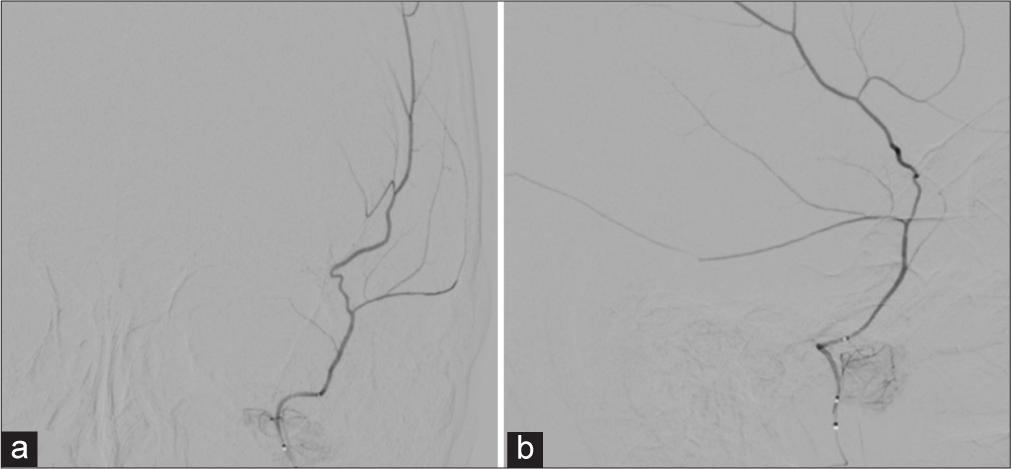
La terapia endovascular se fundamenta en los hallazgos histológicos y ultra estructurales que muestran a la membrana externa del hematoma como la causante de los micro sangrados, mientras que la membrana interna es la responsable de la licuefacción del hematoma.[
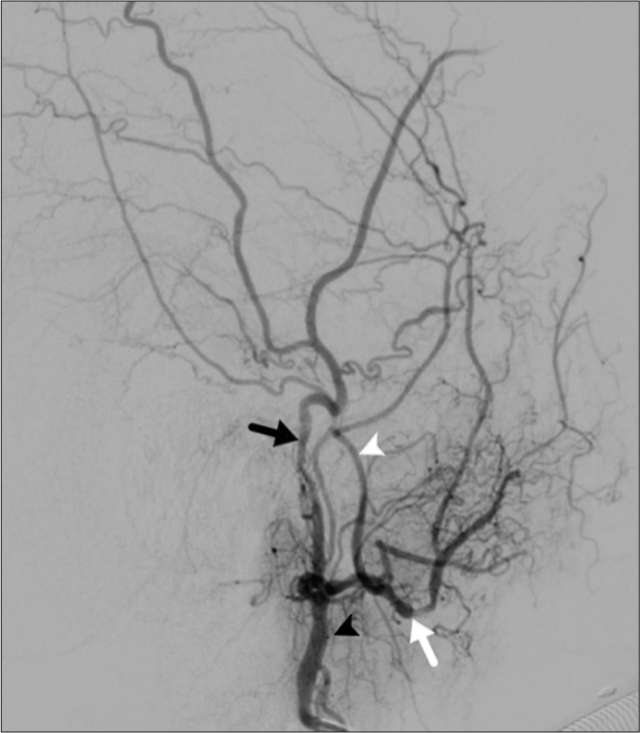
Figura 5:
Angiografía selectiva arteria carótida externa izquierda (punta de flecha negra), se notan la arteria temporal superficial (flecha negra), arteria maxilar interna (flecha blanca), arteria meníngea media (punta de flecha blanca: nótese el ángulo agudo que forma en su ingreso al cráneo por el foramen espinoso).
CONTROVERSIAS DE LA EMBOLIZACIÓN
Los estudios sobre el manejo endovascular tienen como problemas la heterogeneidad del material usado como embolizante, la indicación de tratamiento, ya sea primario o secundario, y que, en muchos casos, no se agotaron las opciones médicas como el uso de atorvastatina.[
Se ha propuesto la embolización como tratamiento primario y también secundario.[
COMPLICACIONES DE LA EMBOLIZACIÓN
Desde su primera descripción por Mandai et al., la embolización de la arteria meníngea media como tratamiento del HSDC recurrente muestra seguridad del procedimiento; sin embargo, esto no la exime de complicaciones.[
RESOLUCIÓN ESPONTÁNEA
Esta descripta la resolución espontánea en el HSDC pero es infrecuente; además, el tiempo de resolución es entre 4 a 8 meses aproximadamente.[
CONCLUSIONES
El HSDC es una patología asociada al envejecimiento, estudiada extensamente y considerada de forma errónea como benigna. Por las comorbilidades de estos pacientes puede ser incapacitante y mortal. Un problema importante en su manejo es la recurrencia; a pesar de esto, la cirugía sigue siendo el Gold estándar. El consumo de antitrombóticos complica la elección y momento óptimo del tratamiento. Actualmente, hay varios estudios en marcha con la finalidad de optimizar el manejo quirúrgico y esclarecer el rol tanto del tratamiento farmacológico como del endovascular.
PUNTOS CLAVE
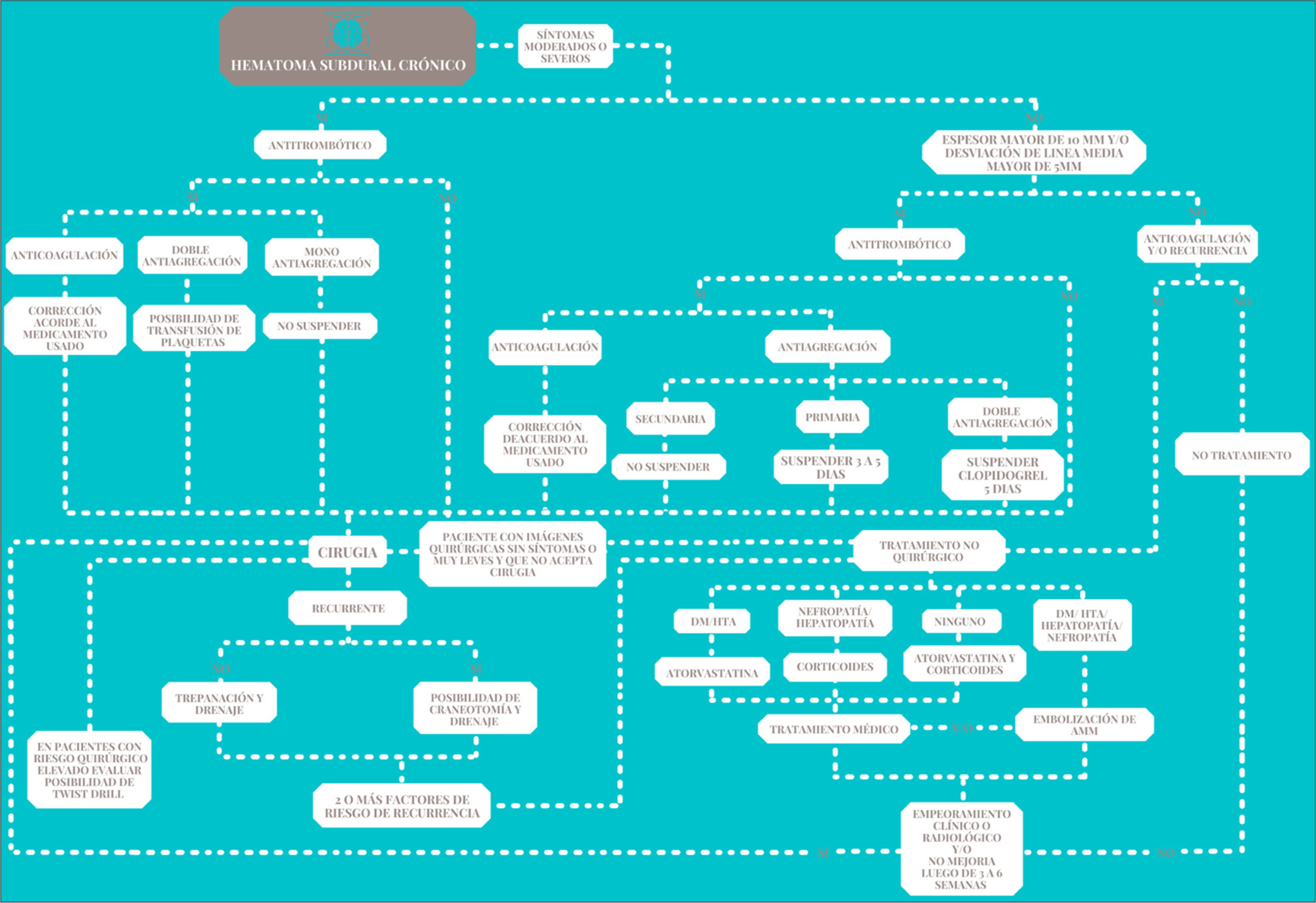
HSDC es una patología cuya incidencia se encuentra en incremento a nivel mundial[ Las dos etiologías más relevantes son los higromas y los hematomas subdurales agudos[ Su fisiopatología se explica por un proceso inflamatorio localizado, seguido de proliferación vascular y fenómenos osmóticos que llevan a su progresión[ La membrana externa del hematoma es la responsable de los micro sangrados a repetición y la interna de la licuefacción del hematoma[ Los factores de riesgo para la formación del HSDC son la edad, el uso de antitrombóticos, diabetes mellitus, entre otros[ La recurrencia es el principal problema del manejo del HSDC[ Existen diferentes definiciones de recurrencia, pero todas concuerdan en la recaída del paciente por síntomas y/o imágenes[ Los factores de riesgo para la recurrencia son la bilateralidad, hematomas laminados y separados en la clasificación de Nakaguchi, neumoencéfalo más de 30 cc, agujeros de trepanación pequeños (menos de 2,5 cm), drenaje orientado hacia parietal[ La cirugía sigue siendo el Gold Standard en el manejo del HSDC[ El procedimiento quirúrgico de elección en la actualidad continúa siendo la trepanación craneal por burr hole[ El uso de drenaje Jackson Pratt está justificado para la prevención de la recurrencia del HSDC[ Los estudios parecen indicar que el drenaje epicraneal es similar al subdural para prevenir la recurrencia y con menores riesgos de complicaciones, pero falta más evidencia[ No hay evidencia que justifique la apertura quirúrgica de la membrana visceral del hematoma para evitar recurrencias[ En cuanto a la irrigación, los estudios no son concluyentes. Existen indicios de que este procedimiento conlleva a un incremento en el riesgo de pneumoencéfalo[ No hay suficientes estudios para sustentar el retraso de la cirugía cuando el paciente usa antiagregantes, sobre todo si son sintomáticos[ Los resultados de múltiples trabajos sobre antitrombóticos como factor de riesgo para la recurrencia son contradictorios y no parecen tener asociación clara con la recurrencia[ Por recomendación de expertos se sugiere la corrección de la anticoagulación previa a la cirugía [ El reinicio de la anticoagulación parece ser más seguro entre la tercera y cuarta semana post operatoria[ No hay evidencia que justifique la suspensión de la mono anti agregación a dosis bajas en pacientes que la reciban como prevención primaria y/o requieran cirugía de emergencia [ En pacientes que no requieran cirugía de emergencia y reciban antiagregantes como prevención primaria, el tiempo de suspensión del antiagregante debe ser entre 3 a 5 días[ En los casos de antiagregación doble que no requieran cirugía de emergencia se debe suspender el clopidogrel por 5 días [ El reinicio de la antiagregación debe ser temprano, según las publicaciones, tan pronto como entre 6 y 24 horas post cirugía, además se debe considerar el momento del retiro del dren[ Actualmente existen varios estudios a favor de la seguridad y efectividad de la atorvastatina a bajas dosis como tratamiento médico del HSDC, pero aún se requiere más evidencia[ Existe algunos trabajos que sugieren la efectividad de los corticoides en el manejo medico; sin embargo, aún faltan más ensayos clínicos para esclarecer su papel[ El uso combinado de atorvastatina a bajas dosis con corticoides parece tener un efecto sinérgico[ Hay poca bibliografía para recomendar el uso del ácido tranexámico como tratamiento del HSDC debido a que implica muchos riesgos y contraindicaciones[ La embolización de la arteria meníngea media parece un tratamiento promisorio para casos selectos. Faltan más estudios para definir su seguridad, efectividad y costos por procedimiento[ En la actualidad, esperar la resolución espontánea del HSDC no tributario de cirugía podría ser reemplazada por el manejo médico o endovascular.[
Declaration of patient consent
The authors certify that they have obtained all appropriate patient consent.
Financial support and sponsorship
Nil.
Conflict of interest
There are no conflict of interest.
References
1. Almenawer SA, Farrokhyar F, Hong C, Alhazzani W, Manoranjan B, Yarascavitch B. Chronic subdural hematoma management: A systematic review and meta-analysis of 34829 patients. Ann Surg. 2014. 259: 449-57
2. Arai N, Mine Y, Kagami H, Maruyama M, Daikoh A, Inaba M. Safe burr hole surgery for chronic subdural hematoma using dabigatran with idarucizumab. World Neurosurg. 2018. 109: 432-5
3. Aspegren OP, Åstrand R, Lundgren MI, Romner B. Anticoagulation therapy a risk factor for the development of chronic subdural hematoma. Clin Neurol Neurosurg. 2013. 115: 981-4
4. Bakheet MF, Pearce LA, Hart RG. Effect of addition of clopidogrel to aspirin on subdural hematoma: Meta-analysis of randomized clinical trials. Int J Stroke. 2014. 10: 501-5
5. Barlinn J, Gerber J, Barlinn K, Pallesen LP, Siepmann T, Zerna C. Acute endovascular treatment delivery to ischemic stroke patients transferred within a telestroke network: A retrospective observational study. Int J Stroke. 2017. 12: 502-9
6. Bartek J, Sjåvik K, Kristiansson H, Ståhl F, Fornebo I, Förander P. Predictors of recurrence and complications after chronic subdural hematoma surgery: A population-based study. World Neurosurg. 2017. 106: 609-14
7. Bartley A, Jakola AS, Bartek J, Sundblom J, Förander P, Marklund N. The swedish study of irrigation-fluid temperature in the evacuation of chronic subdural hematoma (SIC!): Study protocol for a multicenter randomized controlled trial. Trials. 2017. 18: 1-6
8. Bartley A, Jakola AS, Tisell M. The influence of irrigation fluid temperature on recurrence in the evacuation of chronic subdural hematoma. Acta Neurochir (Wien). 2020. 162: 485-8
9. Blouin C, Tirado Rao E, Ortega FM.editors. La Situación de la Población Adulta Mayor en el Perú: Camino a Una Nueva Política;. 2018. p.
10. Bourgeois P, Sleiman M, Louis E, Haddad E, Touzet G. Chronic subdural hematoma in elderly patients over 80. Comments. Neurochirurgie. 1999. 45: 124-8
11. Brennan PM, Kolias AG, Joannides AJ, Shapey J, Marcus HJ, Gregson BA. The management and outcome for patients with chronic subdural hematoma: A prospective, multicenter, observational cohort study in the United Kingdom. J Neurosurg. 2016. 127: 732-9
12. Castro-Rodríguez C, Román-Pena P, Arán-Echabe E, Gelabert-González M. Chronic subdural haematomas in very elderly patients. Rev Española Geriatría Gerontol. 2016. 51: 309-16
13. Cenic A, Bhandari M, Reddy K. Management of chronic subdural hematoma: A national survey and literature review. Can J Neurol Sci. 2005. 32: 501-6
14. Chan DY, Chan DT, Sun TF, Ng SC, Wong GK, Poon WS. The use of atorvastatin for chronic subdural haematoma: A retrospective cohort comparison study. Br J Neurosurg. 2017. 31: 72-7
15. Chan DY, Sun TF, Poon WS. Steroid for chronic subdural hematoma? A prospective phase IIB pilot randomized controlled trial on the use of dexamethasone with surgical drainage for the reduction of recurrence with reoperation. Chin Neurosurg J. 2015. 1: 1-5
16. Chari A, Hocking KC, Broughton E, Turner C, Santarius T, Hutchinson PJ. Core outcomes and common data elements in chronic subdural hematoma: A systematic review of the literature focusing on reported outcomes. J Neurotrauma. 2016. 33: 1212-9
17. Chari A, Morgado TC, Rigamonti D. Recommencement of anticoagulation in chronic subdural haematoma: A systematic review and meta-analysis. Br J Neurosurg. 2014. 28: 2-7
18. Chari AK, Borg N, Hutchinson PJ, Santarius T.editors. Medical and surgical management of chronic subdural hematoma. Youmans and Winn Neurological Surgery. Philadelphia, PA: Elsevier; 2017. p. 729-37
19. Chavakula V, Yan SC, Huang KT, Liu J, Bi WL, Rozman P. Subdural pneumocephalus aspiration reduces recurrence of chronic subdural hematoma. Oper Neurosurg (Hagerstown). 2019. 18: 391-7
20. Choi J, Pyen J, Cho S, Kim J, Koo Y, Whang K. Influence of antithrombotic medication on the risk of chronic subdural hematoma recurrence after burr-hole surgery. J Korean Neurosurg Soc. 2020. 63: 513-8
21. Collet JP, Himbert D, Steg PG. Myocardial infarction after aspirin cessation in stable coronary artery disease patients. Int J Cardiolo. 2000. 76: 257-8
22. Croce MA, Dent DL, Menke PG, Robertson JT, Hinson MS, Young BH. Acute subdural hematoma: Nonsurgical management of selected patients. J Trauma. 1994. 36: 820-6
23. Delgado-López P, Martín-Velasco V, Castilla-Díez J, Rodríguez-Salazar A, Galacho-Harriero A, FernándezArconada O. Dexamethasone treatment in chronic subdural haematoma. Neurocirugia (Astur). 2009. 20: 346-59
24. Ding H, Liu S, Quan X, Liao S, Liu L. Subperiosteal versus subdural drain after burr hole drainage for chronic subdural hematomas: A systematic review and meta-analysis. World Neurosurg. 2020. 136: 90-100
25. Dolinskas CA, Zimmerman RA, Bilaniuk LT, Gennarelli TA. Computed tomography of post-traumatic extracerebral hematomas: Comparison to pathophysiology and responses to therapy. J Trauma. 1979. 19: 163-9
26. Ducruet AF, Grobelny BT, Zacharia BE, Hickman ZL, DeRosa PL, Anderson K. The surgical management of chronic subdural hematoma. Neurosurg Rev. 2012. 35: 155-69
27. Edlmann E, Holl D, Lingsma HF, Bartek J, Bartley A, Duerinck J. Systematic review of current randomised control trials in chronic subdural haematoma and proposal for an international collaborative approach. Acta Neurochir (Wien). 2020. 162: 763-76
28. Emich S, Richling B, McCoy MR, Al-Schameri RA, Ling F, Sun L. The efficacy of dexamethasone on reduction in the reoperation rate of chronic subdural hematoma-the DRESH study: Straightforward study protocol for a randomized controlled trial. Trials. 2014. 15: 1-10
29. Fan Y-S, Wang B, Wang D, Xu X, Gao C, Li Y. Atorvastatin combined with low-dose dexamethasone for vascular endothelial cell dysfunction induced by chronic subdural hematoma. Neural Regen Res. 2021. 16: 523-30
30. Feng Z, Chen Z. Middle meningeal artery embolization for chronic subdural hematoma: A series of 60 cases. Neurosurgery. 2019. 85: E394-4
31. Fernandes de Oliveira M. Chronic subdural hematomas and pursuit of nonsurgical treatment alternatives. World Neurosurg. 2019. 126: 481-3
32. FitzGerald GA, Oates JA, Hawiger J, Maas RL, Roberts LJ, Lawson JA. Endogenous biosynthesis of prostacyclin and thromboxane and platelet function during chronic administration of aspirin in man. J Clin Invest. 1983. 71: 676-88
33. Foreman PM, Mooney J, Ilyas A, Agee B, Vivekanandan S, Fong RP. Antiplatelet medication and operative subdural hematomas: A retrospective cohort study evaluating reoperation rates. World Neurosurg. 2019. 125: e671-7
34. Frontera JA, Lewin JJ, Rabinstein AA, Aisiku IP, Alexandrov AW, Cook AM. Guideline for reversal of antithrombotics in intracranial hemorrhage: Executive summary. A statement for healthcare professionals from the neurocritical care society and the society of critical care medicine. Crit Care Med. 2016. 44: 2251-7
35. Funai M, Osuka K, Usuda N, Atsuzawa K, Inukai T, Yasuda M. Activation of PI3 kinase/Akt signaling in chronic subdural hematoma outer membranes. J Neurotrauma. 2011. 28: 1127-31
36. Gernsback J, Kolcun JP, Jagid J. To drain or two drains: Recurrences in chronic subdural hematomas. World Neurosurg. 2016. 95: 447-50
37. Glover D, Labadie EL. Physiopathogenesis of subdural hematomas: Part 2: Inhibition of growth of experimental hematomas with dexamethasone. J Neurosurg. 1976. 45: 393-7
38. Gonugunta V, Buxton N. Warfarin and chronic subdural haematomas. Br J Neurosurg. 2001. 15: 514-7
39. Guilfoyle MR, Hutchinson PJ, Santarius T. Improved long-term survival with subdural drains following evacuation of chronic subdural haematoma. Acta Neurochir (Wien). 2017. 159: 903-5
40. Haldrup M, Ketharanathan B, Debrabant B, Schwartz OS, Mikkelsen R, Fugleholm K. Embolization of the middle meningeal artery in patients with chronic subdural hematoma-a systematic review and meta-analysis. Acta Neurochir (Wien). 2020. 162: 777-84
41. Han HJ, Park CW, Kim EY, Yoo CJ, Kim YB, Kim WK. One vs. two burr hole craniostomy in surgical treatment of chronic subdural hematoma. J Korean Neurosurg Soc. 2009. 46: 87-92
42. He C, Xia P, Xu J, Chen L, Zhang Q. Evaluation of the efficacy of atorvastatin in the treatment for chronic subdural hematoma: A meta-analysis. Neurosurg Rev. 2021. 44: 479-84
43. Heringer LC, Sousa UO, Oliveira MF, Nunes AS, Alves KA, Zancanaro ML. The number of burr holes and use of a drain do not interfere with surgical results of chronic subdural hematomas. Arq Neuropsiquiatr. 2017. 75: 809-12
44. Hirofumi N, Akira F, Motomasa K, Shuzoh M, Hideo N, Tetsuo W. Spontaneous resolution of chronic subdural hematomas. Neurosurgery. 1986. 19: 794-8
45. Hiroshi N, Takeo T, Norio Y. Relationship between drainage catheter location and postoperative recurrence of chronic subdural hematoma after burr-hole irrigation and closed-system drainage. J Neurosurg. 2000. 93: 791-5
46. Holl DC, Volovici V, Dirven CM, Peul WC, van Kooten F, Jellema K. Pathophysiology and nonsurgical treatment of chronic subdural hematoma: From past to present to future. World Neurosurg. 2018. 116: 402-11.e2
47. Holl DC, Volovici V, Dirven CM, van Kooten F, Miah IP, Jellema K. Corticosteroid treatment compared with surgery in chronic subdural hematoma: A systematic review and meta-analysis. Acta Neurochir (Wien). 2019. 161: 1231-42
48. Huang GH, Li XC, Ren L, Dai RX, Sun ZL, Jiang XF. Take it seriously or not: Postoperative pneumocephalus in CSDH patients?. Br J Neurosurg. 2020. 34: 284-9
49. Huang J, Li L, Zhang J, Gao C, Quan W, Tian Y. Treatment of relapsed chronic subdural hematoma in four young children with atorvastatin and low-dose dexamethasone. Pharmacotherapy. 2019. 39: 783-9
50. Iftikhar M, Siddiqui UT, Rauf MY, Malik AO, Javed G. Comparison of irrigation versus no irrigation during burr hole evacuation of chronic subdural hematoma. J Neurol Surg A Cent Eur Neurosurg. 2016. 77: 416-21
51. 52. 53. Iorio-Morin C, Blanchard J, Richer M, Mathieu D. Tranexamic acid in chronic subdural hematomas (TRACS): Study protocol for a randomized controlled trial. Trials. 2016. 17: 1-11 54. İplikçioğlu AC. Letter: Middle meningeal artery embolization for chronic subdural hematoma: A series of 60 cases. Neurosurgery. 2020. 87: E418 55. Jack A, O’Kelly C, McDougall C, Findlay JM. Predicting recurrence after chronic subdural haematoma drainage. Can J Neurol Sci. 2015. 42: 34-9 56. Jiang R, Zhao S, Wang R, Feng H, Zhang J, Li X. Safety and efficacy of atorvastatin for chronic subdural hematoma in chinese patients: A randomized clinical trial. JAMA Neurol. 2018. 75: 1338-46 57. Kageyama H, Toyooka T, Tsuzuki N, Oka K. Nonsurgical treatment of chronic subdural hematoma with tranexamic acid. J Neurosurg. 2013. 119: 332-7 58. Kamenova M, Nevzati E, Lutz K, Dolp A, Fandino J, Mariani L. Burr-hole drainage for chronic subdural hematoma under low-dose acetylsalicylic acid: A comparative risk analysis study. World Neurosurg. 2017. 100: 594-600 59. Kanazawa T, Takahashi S, Minami Y, Jinzaki M, Toda M, Yoshida K. Prediction of postoperative recurrence of chronic subdural hematoma using quantitative volumetric analysis in conjunction with computed tomography texture analysis. J Clin Neurosci. 2020. 72: 270-6 60. Kazuo T, Keiichirou M, Akira I, Masaaki U, Yoshihumi O, Takaaki K. The relationship of preoperative magnetic resonance imaging findings and closed system drainage in the recurrence of chronic subdural hematoma. J Neurosurg. 1997. 87: 870-5 61. Kitazono M, Yokota H, Satoh H, Onda H, Matsumoto G, Fuse A. Measurement of inflammatory cytokines and thrombomodulin in chronic subdural hematoma. Neurol Med Chir (Tokyo). 2012. 52: 810-5 62. Kolias AG, Chari A, Santarius T, Hutchinson PJ. Chronic subdural haematoma: Modern management and emerging therapies. Nat Rev Neurol. 2014. 10: 570-8 63. Korte W, Cattaneo M, Chassot PG, Eichinger S, von Heymann C, Hofmann N. Peri-operative management of antiplatelet therapy in patients with coronary artery disease: Joint position paper by members of the working group on perioperative haemostasis of the society on thrombosis and haemostasis research (GTH), the working group on perioperative coagulation of the austrian society for anesthesiology, resuscitation and intensive care (ÖGARI) and the working group thrombosis of the European society for cardiology (ESC). Thromb Haemost. 2011. 105: 743-9 64. Kothari RU, Brott T, Broderick JP, Barsan WG, Sauerbeck LR, Zuccarello M. The ABCs of measuring intracerebral hemorrhage volumes. Stroke. 1996. 27: 1304-5 65. Kravtchouk AD, Likhterman LB, Potapov AA, El-Kadi H. Postoperative complications of chronic subdural hematomas: Prevention and treatment. Neurosurg Clin N Am. 2000. 11: 547-52 66. Kuroki T, Katsume M, Harada N, Yamazaki T, Aoki K, Takasu N. Strict closed-system drainage for treating chronic subdural haematoma. Acta Neurochir (Wien). 2001. 143: 1041-4 67. Kutty RK, Leela SK, Sreemathyamma SB, Sivanandapanicker JL, Asher P, Peethambaran A. The outcome of medical management of chronic subdural hematoma with tranexamic acid-a prospective observational study. J Stroke Cerebrovasc Dis. 2020. 29: 105273 68. Kutty SA, Johny M. Chronic subdural hematoma: A comparison of recurrence rates following burr-hole craniostomy with and without drains. Turk Neurosurg. 2014. 24: 494-7 69. Kuwabara M, Sadatomo T, Yuki K, Migita K, Imada Y, Shimizu K. The effect of irrigation solutions on recurrence of chronic subdural hematoma: A consecutive cohort study of 234 patients. Neurol Med Chir (Tokyo). 2017. 57: 210-6 70. Labadie EL, Glover D. Physiopathogenesis of subdural hematomas: Part 1: Histological and biochemical comparisons of subcutaneous hematoma in rats with subdural hematoma in man. J Neurosurg. 1976. 45: 382-92 71. Ladina G, Katharina L, Javier F, Luigi M, Raphael G, Jehuda S. Drain type after burr-hole drainage of chronic subdural hematoma in geriatric patients: A subanalysis of the cSDH-drain randomized controlled trial. Neurosurg Focus. 2020. 49: E6 72. Lee K, Bae W, Yoon S, Doh J, Bae H, Yun I. Location of the chronic subdural haematoma: Role of the gravity and cranial morphology. Brain Inj. 2001. 15: 47-52 73. Lee KS, Bae WK, Bae HG, Yun IG. The fate of traumatic subdural hygroma in serial computed tomographic scans. J Korean Med Sci. 2000. 15: 560-8 74. Lee KS, Bae WK, Doh JW, Bae HG, Yun IG. Origin of chronic subdural haematoma and relation to traumatic subdural lesions. Brain Inj. 1998. 12: 901-10 75. Lee KS, Doh JW, Bae HG, Yun IG. Relations among traumatic subdural lesions. J Korean Med Sci. 1996. 11: 55-63 76. Lee KS. Review natural history of chronic subdural haematoma. Brain Inj. 2004. 18: 351-8 77. Lee L, Ker J, Ng HY, Munusamy T, King NK, Kumar D. Outcomes of chronic subdural hematoma drainage in nonagenarians and centenarians: A multicenter study. J Neurosurg. 2016. 124: 546-51 78. Lee SH, Choi JI, Lim DJ, Ha SK, Kim SD, Kim SH. The potential of diffusion-weighted magnetic resonance imaging for predicting the outcomes of chronic subdural hematomas. J Korean Neurosurg Soc. 2018. 61: 97-104 79. Lindvall P, Koskinen LO. Anticoagulants and antiplatelet agents and the risk of development and recurrence of chronic subdural haematomas. J Clin Neurosci. 2009. 16: 1287-90 80. Macdonald L.editors. Pathophysiology of chronic subdural hematomas. Youmans and Winn Neurological Surgery. Philadelphia, PA: Elsevier; 2017. p. 721-7 81. Mantz J, Samama CM, Tubach F, Devereaux PJ, Collet JP, Albaladejo P. Impact of preoperative maintenance or interruption of aspirin on thrombotic and bleeding events after elective non-cardiac surgery: The multicentre, randomized, blinded, placebo-controlled, STRATAGEM trial. Br J Anaesth. 2011. 107: 899-910 82. Markwalder TM, Seiler RW. Chronic subdural hematomas: To drain or not to drain?. Neurosurgery. 1985. 16: 185-8 83. Markwalder TM, Steinsiepe KF, Rohner M, Reichenbach W, Markwalder H. The course of chronic subdural hematomas after burr-hole craniostomy and closed-system drainage. J Neurosurg. 1981. 55: 390-6 84. Martinez-Perez R, Rayo N, Tsimpas A.editors. Endovascular embolisation of the middle meningeal artery to treat chronic subdural haematomas: Effectiveness, safety, and the current controversy. A systematic review. Neurología. 2020. p. 85. Mebberson K, Colditz M, Marshman L, Thomas P, Mitchell P, Robertson K. Prospective randomized placebo-controlled double-blind clinical study of adjuvant dexamethasone with surgery for chronic subdural haematoma with postoperative subdural drainage: Interim analysis. J Clin Neurosci. 2020. 71: 153-7 86. Miah IP, Holl DC, Peul WC, Walchenbach R, Kruyt N, de Laat K. Dexamethasone therapy versus surgery for chronic subdural haematoma (DECSA trial): Study protocol for a randomised controlled trial. Trials. 2018. 19: 1-10 87. Miranda LB, Braxton E, Hobbs J, Quigley MR. Chronic subdural hematoma in the elderly: Not a benign disease. J Neurosurg. 2011. 114: 72-6 88. Mori K, Maeda M. Surgical treatment of chronic subdural hematoma in 500 consecutive cases: Clinical characteristics, surgical outcome, complications, and recurrence rate. Neurol Med Chir (Tokyo). 2001. 41: 371-81 89. Motiei-Langroudi R, Stippler M, Shi S, Adeeb N, Gupta R, Griessenauer CJ. Factors predicting reoperation of chronic subdural hematoma following primary surgical evacuation. J Neurosurg. 2017. 129: 1143-50 90. Motoie R, Karashima S, Otsuji R, Ren N, Nagaoka S, Maeda K. Recurrence in 787 patients with chronic subdural hematoma: Retrospective cohort investigation of associated factors including direct oral anticoagulant use. World Neurosurg. 2018. 118: e87-91 91. Nagatani K, Wada K, Takeuchi S, Nawashiro H. Corticosteroid suppression of vascular endothelial growth factor and recurrence of chronic subdural hematoma. Neurosurgery. 2012. 70: E1334 92. Nakaguchi H, Tanishima T, Yoshimasu N. Factors in the natural history of chronic subdural hematomas that influence their postoperative recurrence. J Neurosurg. 2001. 95: 256-62 93. Nanko N, Tanikawa M, Mase M, Fujita M, Tateyama H, Miyati T. Involvement of hypoxia-inducible factor-1α and vascular endothelial growth factor in the mechanism of development of chronic subdural hematoma. Neurol Med Chir (Tokyo). 2009. 49: 379-85 94. Nathan S, Goodarzi Z, Jette N, Gallagher C, Holroyd-Leduc J. Anticoagulant and antiplatelet use in seniors with chronic subdural hematoma. Neurology. 2017. 88: 1889 95. Ohba S, Kinoshita Y, Nakagawa T, Murakami H. The risk factors for recurrence of chronic subdural hematoma. Neurosurg Rev. 2013. 36: 145-50 96. Oishi M, Toyama M, Tamatani S, Kitazawa T, Saito M. Clinical factors of recurrent chronic subdural hematoma. Neurol Med Chir (Tokyo). 2001. 41: 382-6 97. Okada Y, Akai T, Okamoto K, Iida T, Takata H, Iizuka H. A comparative study of the treatment of chronic subdural hematoma-burr hole drainage versus burr hole irrigation. Surg Neurol. 2002. 57: 405-9 98. Osuka K, Watanabe Y, Usuda N, Atsuzawa K, Shima H, Takeuchi M. Activation of JAK-STAT3 signaling pathway in chronic subdural hematoma outer membranes. Neurosci Lett. 2013. 534: 166-70 99. Park C, Choi K, Kim M, Kang J, Choi C. Spontaneous evolution of posttraumatic subdural hygroma into chronic subdural haematoma. Acta Neurochir (Wien). 1994. 127: 41-7 100. Park KS, Park SH, Hwang SK, Kim C, Hwang JH. Correlation of the beta-trace protein and inflammatory cytokines with magnetic resonance imaging in chronic subdural hematomas: A prospective study. J Korean Neurosurg Soc. 2015. 57: 235 101. Petralia CC, Manivannan S, Shastin D, Sharouf F, Elalfy O, Zaben M. Effect of steroid therapy on risk of subsequent surgery for neurologically stable chronic subdural hemorrhage-retrospective cohort study and literature review. World Neurosurg. 2020. 138: e35-41 102. Phan K, Abi-Hanna D, Kerferd J, Lu VM, Dmytriw AA, Ho YT. Resumption of antithrombotic agents in chronic subdural hematoma: A systematic review and meta-analysis. World Neurosurg. 2018. 109: e792-9 103. Poon MT, Rea C, Kolias AG, Brennan PM, Afshari FT, Ahmed AI. Influence of antiplatelet and anticoagulant drug use on outcomes after chronic subdural hematoma drainage. J Neurotrauma. 2018. 38: 1177-84 104. Poursaid A, Jensen MM, Huo E, Ghandehari H. Polymeric materials for embolic and chemoembolic applications. J Control Release. 2016. 240: 414-33 105. Prud’homme M, Mathieu F, Marcotte N, Cottin S. A pilot placebo controlled randomized trial of dexamethasone for chronic subdural hematoma. Can J Neurol Sci. 2016. 43: 284-90 106. Qiu S, Zhuo W, Sun C, Su Z, Yan A, Shen L. Effects of atorvastatin on chronic subdural hematoma: A systematic review. Medicine (Baltimore). 2017. 96: e7290 107. Quan W, Zhang Z, Li P, Tian Q, Huang J, Qian Y. Role of regulatory T cells in atorvastatin induced absorption of chronic subdural hematoma in rats. Aging Dis. 2019. 10: 992-1002 108. Rusconi A, Sangiorgi S, Bifone L, Balbi S. Infrequent hemorrhagic complications following surgical drainage of chronic subdural hematomas. J Korean Neurosurg Soc. 2015. 57: 379-85 109. Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet. 2020. 395: 473-5 110. Saito H, Tanaka M, Hadeishi H. Angiogenesis in the septum and inner membrane of refractory chronic subdural hematomas: Consideration of findings after middle meningeal artery embolization with low-concentration n-butyl-2-cyanoacrylate. NMC Case Rep J. 2019. 6: 105-10 111. Samama CM, Bastien O, Forestier F, Denninger MH, Isetta C, Juliard JM. Antiplatelet agents in the perioperative period: Expert recommendations of the French society of anesthesiology and intensive care (SFAR) 2001-summary statement. Can J Anaesth. 2002. 49: S26-35 112. Santarius T, Kirkpatrick PJ, Ganesan D, Chia HL, Jalloh I, Smielewski P. Use of drains versus no drains after burr-hole evacuation of chronic subdural haematoma: A randomised controlled trial. Lancet. 2009. 374: 1067-73 113. Santarius T, Lawton R, Kirkpatrick PJ, Hutchinson PJ. The management of primary chronic subdural haematoma: A questionnaire survey of practice in the United Kingdom and the Republic of Ireland. Br J Neurosurg. 2008. 22: 529-34 114. Sato S, Suzuki J. Ultrastructural observations of the capsule of chronic subdural hematoma in various clinical stages. J Neurosurg. 1975. 43: 569-78 115. Schirmer CM, Siddiqui AH. Commentary: Middle meningeal artery embolization for chronic subdural hematoma: A series of 60 cases. Neurosurgery. 2019. 85: E1004-5 116. Serrano L, Manzano-López D, Rubio MA, Patino JD, Villalba G. WEBINO syndrome associated to chronic subdural haematoma. Rev Neurol. 2016. 62: 45-6 117. Shen J, Yuan L, Ge R, Wang Q, Zhou W, Jiang XC. Clinical and radiological factors predicting recurrence of chronic subdural hematoma: A retrospective cohort study. Injury. 2019. 50: 1634-40 118. Siddiq F, Bains NK, Herbert JP, Akhtar IN, Thomas AJ, Kan P. Reliability of an automated computerized hematoma volumetric analysis protocol in patients with chronic subdural hemorrhage. World Neurosurg. 2021. 150: e372-7 119. Soleman J, Lutz K, Schaedelin S, Kamenova M, Guzman R, Mariani L. Subperiosteal vs subdural drain after burr-hole drainage of chronic subdural hematoma: A randomized clinical trial (cSDH-drain-trial). Neurosurgery. 2019. 85: E825-34 120. Soleman J, Nocera F, Mariani L. The conservative and pharmacological management of chronic subdural haematoma. Swiss Med Wkly. 2017. 147: w14398 121. Stanisic M, Aasen AO, Pripp AH, Lindegaard KF, RammPettersen J, Lyngstadaas SP. Local and systemic pro-inflammatory and anti-inflammatory cytokine patterns in patients with chronic subdural hematoma: A prospective study. Inflamm Res. 2012. 61: 845-52 122. Stanisic M, Lund-Johansen M, Mahesparan R. Treatment of chronic subdural hematoma by burr-hole craniostomy in adults: Influence of some factors on postoperative recurrence. Acta Neurochir (Wien). 2005. 147: 1249-57 123. Stanišić M, Pripp AH. A reliable grading system for prediction of chronic subdural hematoma recurrence requiring reoperation after initial burr-hole surgery. Neurosurgery. 2017. 81: 752-60 124. Stary JM, Hutchins L, Vega RA. Tranexamic acid for recurring subdural hematomas following surgical evacuation: A clinical case series. J Neurol Surg A Cent Eur Neurosurg. 2016. 77: 422-6 125. Stippler M, Ramirez P, Berti A, MacIndoe C, Villalobos N, Murray-Krezan C. Chronic subdural hematoma patients aged 90 years and older. Neurol Res. 2013. 35: 243-6 126. Sun T, Boet R, Poon W. Non-surgical primary treatment of chronic subdural haematoma: Preliminary results of using dexamethasone. Br J Neurosurg. 2005. 19: 327-33 127. Suzuki M, Endo S, Inada K, Kudo A, Kitakami A, Kuroda K. Inflammatory cytokines locally elevated in chronic subdural haematoma. Acta Neurochir (Wien). 1998. 140: 51-5 128. Takahashi Y, Sato H, Inoue Y, Takeda S, Ohkawara S. CT findings and the evaluation of chronic subdural hematoma (Part I)-forecast of chronic subdural hematoma. Neurol Med Chir (Tokyo). 1981. 21: 485-90 129. Tanaka T, Kaimori M. Histological study of vascular structure between the dura mater and the outer membrane in chronic subdural hematoma in an adult. No Shinkei Geka. 1999. 27: 431-6 130. Tang R, Shi J, Li X, Zou Y, Wang L, Chen Y. Effects of atorvastatin on surgical treatments of chronic subdural hematoma. World Neurosurg. 2018. 117: e425-9 131. Tanikawa M, Mase M, Yamada K, Yamashita N, Matsumoto T, Banno T. Surgical treatment of chronic subdural hematoma based on intrahematomal membrane structure on MRI. Acta Neurochir (Wien). 2001. 143: 613-9 132. Taussky P, Fandino J, Landolt H. Number of burr holes as independent predictor of postoperative recurrence in chronic subdural haematoma. Br J Neurosurg. 2008. 22: 279-82 133. Theoharides T, Conti P. Dexamethasone for COVID-19? Not so fast. J Biol Regul Homeost Agents. 2020. 34: 1241-3 134. Toi H, Kinoshita K, Hirai S, Takai H, Hara K, Matsushita N. Present epidemiology of chronic subdural hematoma in Japan: Analysis of 63, 358 cases recorded in a national administrative database. J Neurosurg. 2017. 128: 222-8 135. Torihashi K, Sadamasa N, Yoshida K, Narumi O, Chin M, Yamagata S. Independent predictors for recurrence of chronic subdural hematoma: A review of 343 consecutive surgical cases. Neurosurgery. 2008. 63: 1125-9 136. Tseng JH, Tseng MY, Liu AJ, Lin WH, Hu HY, Hsiao SH. Risk factors for chronic subdural hematoma after a minor head injury in the elderly: A population-based study. Biomed Res Int. 2014. 2014: 218646 137. Uda H, Nagm A, Ichinose T, Onishi Y, Yoshimura M, Tsuruno T. Burr hole drainage without irrigation for chronic subdural hematoma. Surg Neurol Int. 2020. 11: 89 138. Uno M, Toi H, Hirai S. Chronic subdural hematoma in elderly patients: Is this disease benign?. Neurol Med Chir (Tokyo). 2017. 57: 402-9 139. Unterhofer C, Freyschlag CF, Thomé C, Ortler M. Opening the internal hematoma membrane does not alter the recurrence rate of chronic subdural hematomas: A prospective randomized trial. World Neurosurg. 2016. 92: 31-6 140. Vespa J, Armstrong DM, Medina L. Demographic Turning Points for the United States: Population Projections for 2020 to 2060: US Department of Commerce, Economics and Statistics Administration, United States; 2018. p. 141. Vujkovac B, Šabovič M. Treatment of subdural and intracerebral haematomas in a haemodialysis patient with tranexamic acid. Nephrol Dial Transplant. 2000. 15: 107-9 142. Wada T, Kuroda K, Yoshida Y, Ogasawara K, Ogawa A, Endo S. Local elevation of the anti-inflammatory interleukin-10 in the pathogenesis of chronic subdural hematoma. Neurosurg Rev. 2006. 29: 242-5 143. Wakai S, Hashimoto K, Watanabe N, Inoh S, Ochiai C, Nagai M. Efficacy of closed-system drainage in treating chronic subdural hematoma: A prospective comparative study. Neurosurgery. 1990. 26: 771-3 144. Wang D, Li T, Wei H, Wang Y, Yang G, Tian Y. Atorvastatin enhances angiogenesis to reduce subdural hematoma in a rat model. J Neurol Sci. 2016. 362: 91-9 145. Wang QP, Yuan Y, Guan JW, Jiang XB. A comparative study of irrigation versus no irrigation during burr hole craniostomy to treat chronic subdural hematoma. BMC Surg. 2017. 17: 99 146. Waqas M, Vakhari K, Weimer PV, Hashmi E, Davies JM, Siddiqui AH. Safety and effectiveness of embolization for chronic subdural hematoma: Systematic review and case series. World Neurosurg. 2019. 126: 228-36 147. Weigel R, Hohenstein A, Schilling L. Vascular endothelial growth factor concentration in chronic subdural hematoma fluid is related to computed tomography appearance and exudation rate. J Neurotrauma. 2014. 31: 670-3 148. Weigel R, Schmiedek P, Krauss JK. Outcome of contemporary surgery for chronic subdural haematoma: Evidence based review. J Neurol Neurosurg Psychiatry. 2003. 74: 937-43 149. Workewych AM.editors. Tranexamic Acid in the Treatment of Residual Chronic Subdural Hematoma: A Single-Centre, Observer-Blinded, Randomized Controlled Trial (TRACE). 2018. p. 150. Wu Q, Liu Q, Chen D, Chen Z, Huang X, Luo M. Subdural drainage techniques for single burr-hole evacuation of chronic subdural hematoma: Two drains frontal-occipital position versus one drain frontal position. Br J Neurosurg. 2021. 35: 324-8 151. Xu C, Chen S, Yuan L, Jing Y. Burr-hole irrigation with closed-system drainage for the treatment of chronic subdural hematoma: A meta-analysis. Neurol Med Chir (Tokyo). 2016. 56: 62-8 152. Xu M, Chen P, Zhu X, Wang C, Shi X, Yu B. Effects of atorvastatin on conservative and surgical treatments of chronic subdural hematoma in patients. World Neurosurg. 2016. 91: 23-8 153. Yadav YR, Parihar V, Namdev H, Bajaj J. Chronic subdural hematoma. Asian J Neurosurg. 2016. 11: 330-42 154. Yamashima T, Kubota T, Yamamoto S. Eosinophil degranulation in the capsule of chronic subdural hematomas. J Neurosurg. 1985. 62: 257-60 155. Yamashima T, Yamamoto S, Friede RL. The role of endothelial gap junctions in the enlargement of chronic subdural hematomas. J Neurosurg. 1983. 59: 298-303 156. Yamashima T, Yamamoto S. The origin of inner membranes in chronic subdural hematomas. Acta Neuropathol. 1985. 67: 219-25 157. Yamashima T. The inner membrane of chronic subdural hematomas: Pathology and pathophysiology. Neurosurg Clin N Am. 2000. 11: 413-24 158. Yang AI, Balser DS, Mikheev A, Offen S, Huang JH, Babb J. Cerebral atrophy is associated with development of chronic subdural haematoma. Brain Inj. 2012. 26: 1731-6 159. Yang K, Qiu M, Zhao H, Liu Z, Zheng L. Clinical Efficacy and safety of atorvastatin for chronic subdural hematoma: A randomized controlled trial. Indian J Pharm Sci. 2020. 82: 88-94 160. Yang W, Huang J. Chronic subdural hematoma: Epidemiology and natural history. Neurosurg Clin. 2017. 28: 205-10 161. Yeon JY, Kong DS, Hong SC. Safety of early warfarin resumption following burr hole drainage for warfarin-associated subacute or chronic subdural hemorrhage. J Neurotrauma. 2011. 29: 1334-41 162. Yokoyama K, Matsuki M, Shimano H, Sumioka S, Ikenaga T, Hanabusa K. Diffusion tensor imaging in chronic subdural hematoma: Correlation between clinical signs and fractional anisotropy in the pyramidal tract. AJNR Am J Neuroradiol. 2008. 29: 1159-63 163. You CG, Zheng XS. Postoperative pneumocephalus increases the recurrence rate of chronic subdural hematoma. Clin Neurol Neurosurg. 2018. 166: 56-60 164. Yuan Y, Wang QP, Cao YL, Zhang H, Burkutally MS, Budryte K. Burr hole drainage and burr hole drainage with irrigation to treat chronic subdural hematoma: A systematic review and meta-analysis. Medicine (Baltimore). 2018. 97: e11827 165. Zhao B, Jia WB, Zhang LY, Wang TZ. 1/2SH: A simple, accurate, and reliable method of calculating the hematoma volume of spontaneous intracerebral hemorrhage. Stroke. 2020. 51: 193-201 166. Zhao KJ, Zhang RY, Sun QF, Wang XQ, Gu XY, Qiang Q. Comparisons of 2/3Sh estimation technique to computer-assisted planimetric analysis in epidural, subdural and intracerebral hematomas. Neurol Res. 2010. 32: 910-7 167. Zheng F, Qiu C, Zou L, Yang S, Krischek B. Middle meningeal artery embolization for chronic subdural hematoma: A series of 60 cases. Neurosurgery. 2019. 85: 801-7 168. Zumofen D, Regli L, Levivier M, Krayenbühl N. Chronic subdural hematomas treated by burr hole trepanation and a subperiostal drainage system. Neurosurgery. 2009. 64: 1116-22