- Center for Advanced Neurology and Neurosurgery, Rio Grande do Sul, Brazil.
- Department of Morphological Sciences, Federal University of Rio Grande Sul, Porto Alegre, Brazil.
- Department of Neurosurgery, Center for Advanced Neurology and Neurosurgery, Porto Alegre, Brazil.
Correspondence Address:
Gustavo Rassier Isolan, Center for Advanced Neurology and Neurosurgery, Porto Alegre, Brazil.
DOI:10.25259/SNI_696_2022
Copyright: © 2022 Surgical Neurology International This is an open-access article distributed under the terms of the Creative Commons Attribution-Non Commercial-Share Alike 4.0 License, which allows others to remix, transform, and build upon the work non-commercially, as long as the author is credited and the new creations are licensed under the identical terms.How to cite this article: Gustavo Rassier Isolan1, Joel Lavinsky2, Victor Matheus Olaves Marques3, Jander Moreira Monteiro3, Ricardo Silva dos Santos3, Paulo Henrique Pires de Aguiar3. Abordajes quirúrgicos de los meningiomas petroclivales Parte 2: revisión narrativa y lo que aprendimos con 30 casos. 11-Nov-2022;13:515
How to cite this URL: Gustavo Rassier Isolan1, Joel Lavinsky2, Victor Matheus Olaves Marques3, Jander Moreira Monteiro3, Ricardo Silva dos Santos3, Paulo Henrique Pires de Aguiar3. Abordajes quirúrgicos de los meningiomas petroclivales Parte 2: revisión narrativa y lo que aprendimos con 30 casos. 11-Nov-2022;13:515. Available from: https://surgicalneurologyint.com/surgicalint-articles/12001/
Abstract
Antecedentes: La resección quirúrgica de los meningiomas petroclivales es un desafío debido a su ubicación profunda y su relación con las estructuras neurovasculares vitales. Por lo general, son lesiones benignas, pero pueden involucrar o infiltrar huesos en la base del cráneo, la duramadre y el tronco encefálico. Esto hace que la extirpación total sea muy difícil o imposible sin causar déficits neurológicos. El objetivo de este estudio es revisar los abordajes quirúrgicos utilizados para tratar los meningiomas petroclivales y las lecciones que hemos aprendido en el manejo quirúrgico de 30 casos.
Métodos: Serie de casos de 30 meningiomas petroclivales. Al comienzo de nuestra serie, utilizamos el abordaje petroso para todos los casos, pero con la adquisición de experiencia comenzamos a indicar cada vez más el abordaje retrosigmoideo, reservando los abordajes petrosos y cráneo-orbitocigomático para casos seleccionados.
Resultados: Debido a la dificultad de acceso, los meningiomas petroclivales generalmente requieren diferentes abordajes quirúrgicos y presentan diferentes dificultades quirúrgicas. Hay tres abordajes principales: fronto-orbito-cigomático y variantes; petroso y variantes; y retrosigmoideo, pudiendo ser combinados. La elección del abordaje quirúrgico generalmente se basa en la ubicación y extensión del tumor, la forma del cráneo y la participación de las estructuras venosas, y la experiencia del cirujano.
Conclusión: Los meningiomas petroclivales son raros y complejos en la base del cráneo. Elegir el abordaje correcto es crucial para un resultado quirúrgico exitoso.
Keywords: Meningioma petroclival, Abordaje quirúrgico, Acceso, Base del cráneo, Tumor cerebral
INTRODUCCIÓN
Los meningiomas petroclivales son tumores raros de crecimiento lento y generalmente solo producen síntomas después de alcanzar grandes dimensiones, lo que puede retrasar su diagnóstico.[
Por definición, los meningiomas petroclivales tienen su origen medial a los pares craneales V, VII, VIII, IX, X y XI, y pueden alcanzar el tentorio.[
La resección quirúrgica de estos meningiomas es un desafío debido a su profundidad y relación con las estructuras neurovasculares vitales. Generalmente son lesiones benignas, pero pueden involucrar o infiltrar tejido cerebral, base del cráneo, duramadre, tronco encefálico y estructuras neurovasculares adyacentes. Debido a la historia natural del crecimiento de estos tumores, la indicación de extirpación quirúrgica suele ser necessária.[
En este estudio presentamos la evolución histórica del manejo de los meningiomas petroclivales y los factores que tenemos en cuenta al elegir el abordaje quirúrgico basado en una serie personal de 30 casos operados entre 2006 y 2018. Los resultados de nuestra serie hasta 2014 se pueden consultar en un artículo anterior y reflejan nuestra filosofía de gestión actual con respecto al abordaje que se utilizará.[
Historia
Existen varias clasificaciones para los meningiomas petroclivales. La primera fue creada por Castellano y Ruggiero en la década de los 50 que clasificó los meningiomas de la fosa posterior. El término meningioma petrocival fue difundido por Maybe y Symon en 1986.[
Genética
Los meningiomas fueron los primeros tumores del SNC cuyas alteraciones genéticas fueron identificadas y relacionadas con la monosomía del cromosoma 22. Desde entonces, las alteraciones en el cromosoma 22 se han asociado con meningiomas, incluido el gen Neurofibromatosis Tipo 2 (NF2) presente en el brazo largo de este cromosoma, siendo la alteración molecular más común en estos tumores. Recientemente, los genes AKT1, KLF4, TRAF7 y SMO se han asociado con el perfil de expresión de NF2. La segunda alteración más frecuente en los meningiomas es la deleción del brazo corto del cromosoma 1 y está asociada con la promoción y progresión de estos tumores. Otros cromosomas también tienen alteraciones descritas en los meningiomas: cromosomas dicéntricos o en anillo, deleciones de brazos 1p, 6q, 7, 9p, 10, 14q, 18q, 19 o 20 o amplificación 1q, 9q, 12q, 15q, 17q o 20q. Las deleciones 14q son más frecuentes en grado I, mientras que las alteraciones 9p, que contienen CDKN2A, CDKN2B y p14ARF se asocian con progresión maligna.[
Otros genes supresores también parecen desempeñar un papel en la progresión y agresividad de los meningiomas, como el gen DAL1 en el brazo largo del cromosoma 18, TIMP1 y TIMP3, ubicados respectivamente en el Xp y 22q. Para comprender la génesis de los meningiomas y su progresión se estudiaron varias vías moleculares, destacando la vía de la proteína quinasa activadora de mitosis (MAPK), retinoblastoma/p53 (RB/p53), alvo mamario de rapamicina (mTOR), Wingless/β- catenina (Wnt), señalización NOCHT (Nocht) y factores de crecimiento.[
En relación a los meningiomas petroclivales, en un estudio de Ohba et al.[
Según un estudio de Kumar et al, se observó que las características histopatológicas, el índice de proliferación celular (Ki-67), la expresión del receptor de progesterona o la proteína p53 en meningiomas petroclivales con resección total o subtotal fueron similares a los meningiomas de convexidad de grado I correspondientes. Sin embargo, a diferencia de los meningiomas de convexidad de grado I, 20% de los meningiomas petroclivales de grado I con resección subtotal mostraron co- deleción 1p/4q, mientras que aquellos con resección total no mostraron esta alteración. Por lo tanto, los tumores petroclivales de grado I que presentan una co-deleción 1p/14q deben tratarse con precaución, porque cuando está presente esta alteración sugiere que estos meningiomas tienen una naturaleza biológica inherentemente agresiva, que se manifiesta como un aumento de la invasividad y el comportamiento local destructivo, dificultando la resección total.[
Utilizamos el marcador de proliferación Ki67 para predecir indirectamente el grado de recurrencia de estos tumores en los casos en que la resección no fue completa.[
DIAGNÓSTICO
Los meningiomas petroclivales, aunque raros, se caracterizan por su crecimiento lento, causando síntomas generalmente cuando alcanzan grandes dimensiones.[
Los síntomas más comunes son dolor de cabeza, trastornos de la marcha, pérdida auditiva, parestesia facial y trastorno de la deglución.[
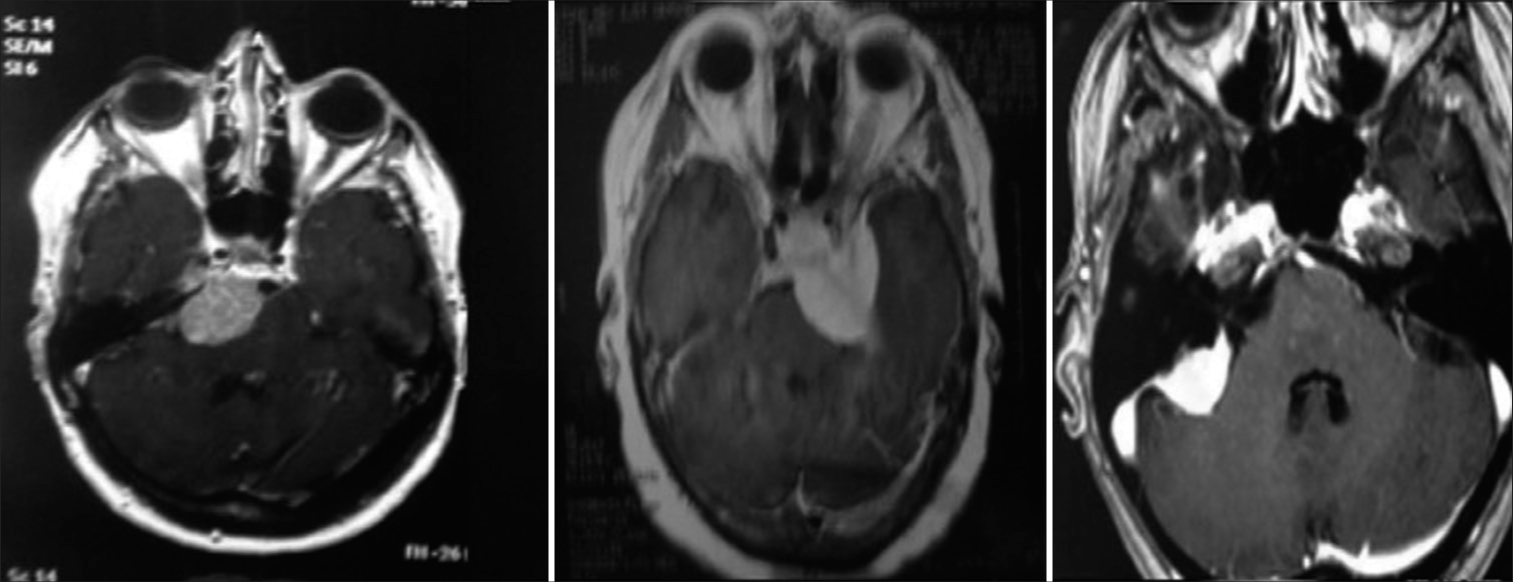
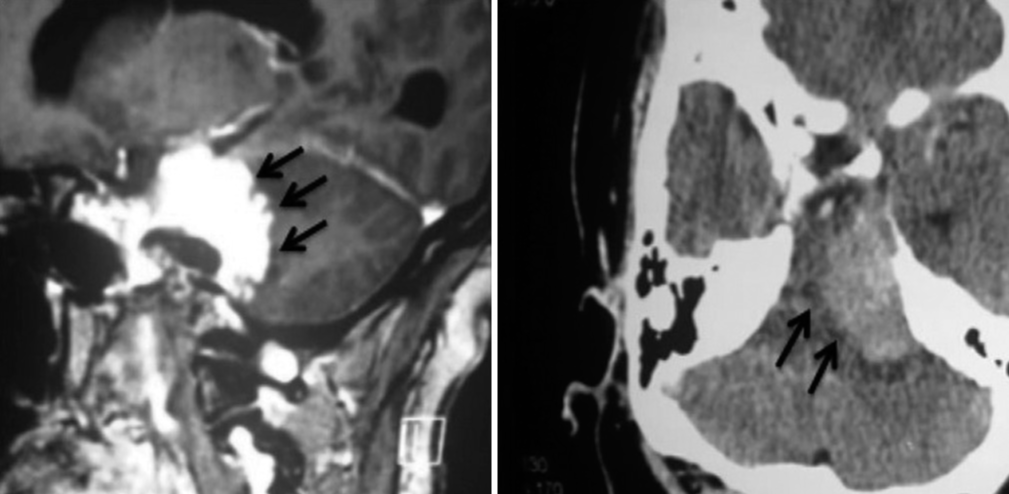
La tomografía computarizada del cráneo es importante para evaluar áreas de erosión ósea o hiperostosis causadas por el tumor, así como para evaluar las estructuras del hueso temporal al planificar abordajes transtemporales. El tumor se caracteriza por una ligera hiperdensidad en comparación con el cerebro y por demostrar un fuerte realce por el contraste. Por lo general, se infiltra en la duramadre y presenta una gran área de implantación en el clivus. Puede presentar calcificaciones e hiperostosis en la región del clivus, lo que puede dificultar su base de implantación.[
La resonancia magnética muestra la extensión y la relación de la lesión con el tronco encefálico, vasos y pares craneales, demostrando claramente cuando se produce el desplazamiento y la compresión de las estructuras normales. La resonancia magnética con gandolinio a menudo demuestra una lesión con realce intenso y homogéneo. En T1 el tumor tiene un aspecto isointenso, mientras que en TR largo (T2 y Flair) es hiperintenso. Además, es bastante hidratado y tiene una superficie externa ligeramente lobulada. La confirmación de edema en T2 en el tronco encefálico caracteriza la invasión de la aracnoides y generalmente es un signo de mal pronóstico cuando se trata de resecar el tumor por completo. [
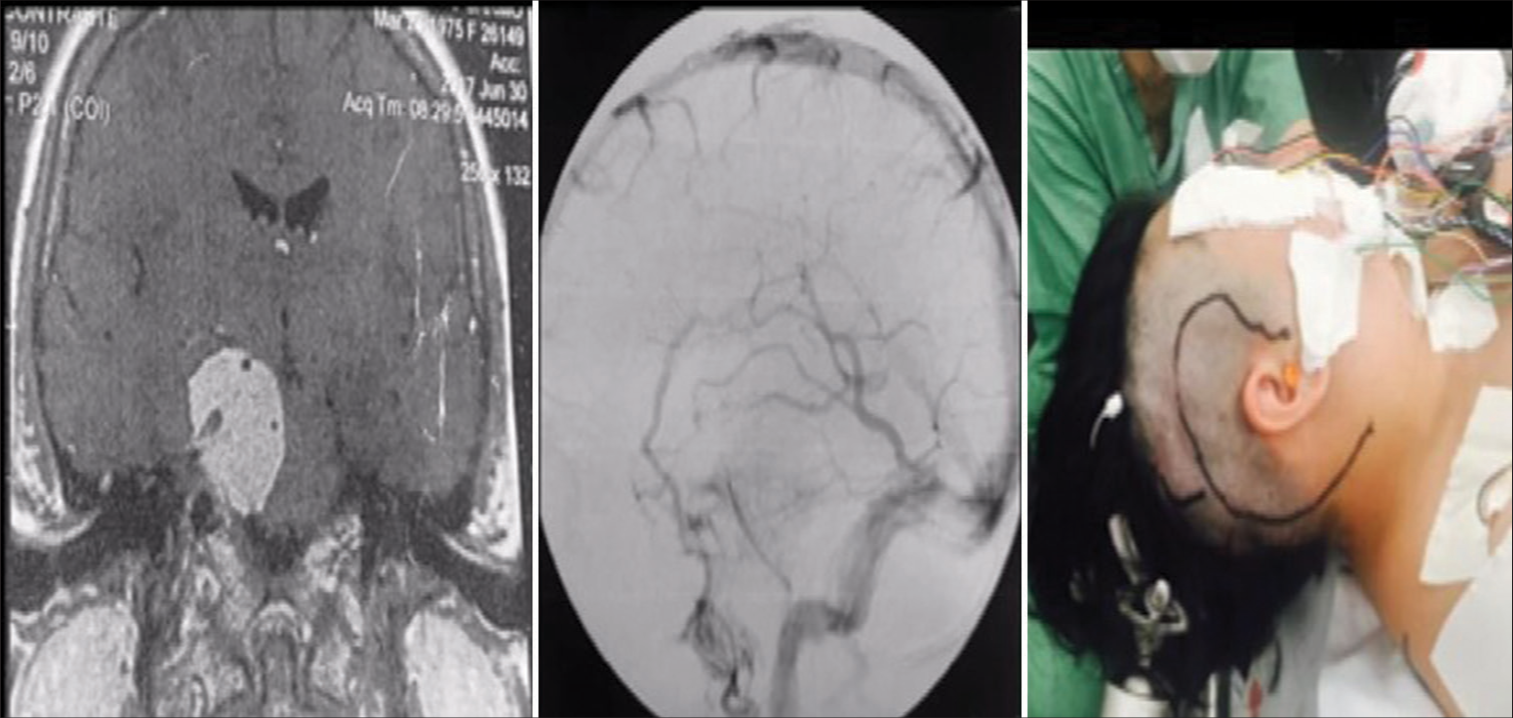
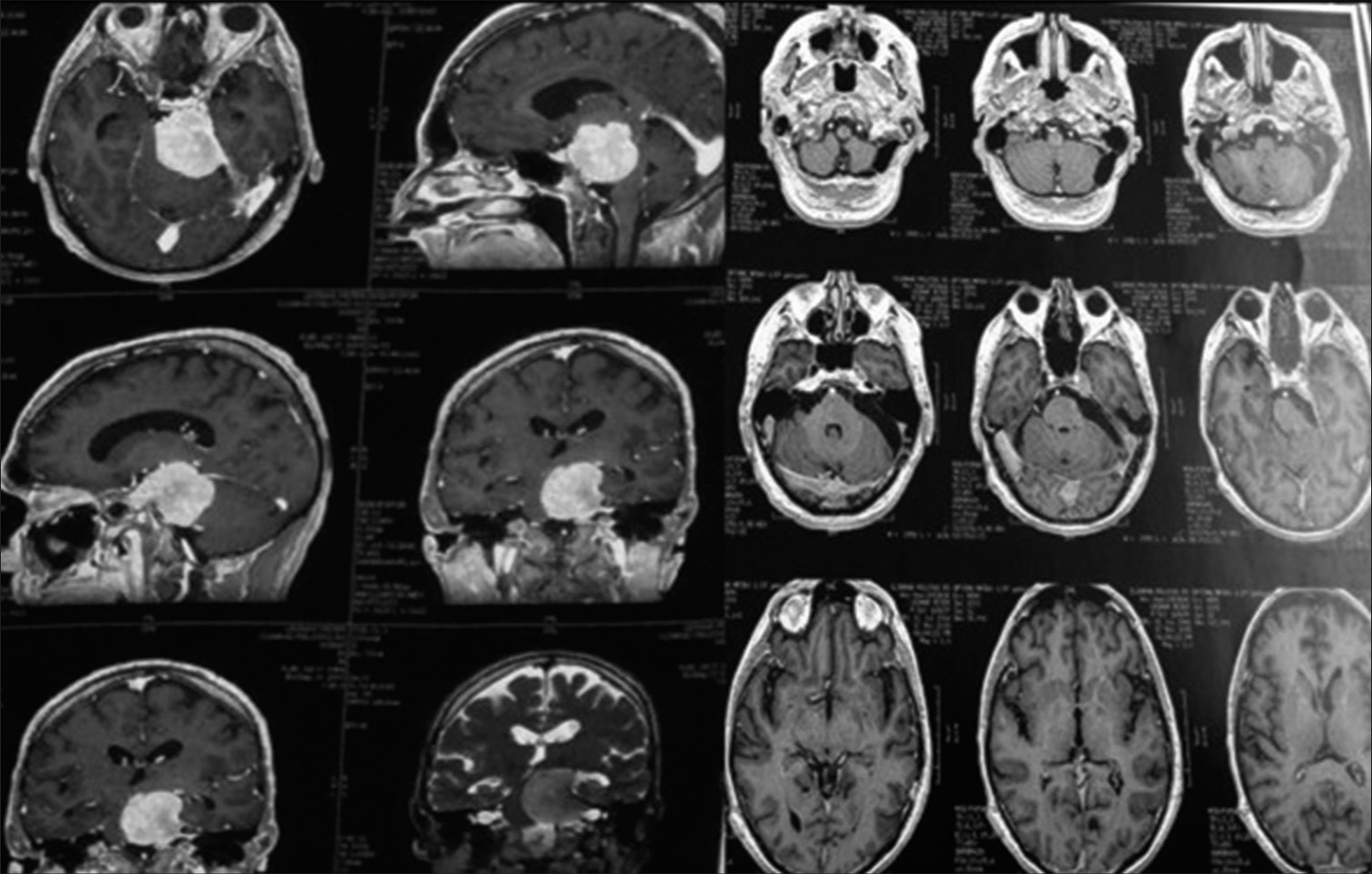
Figura 3:
Resonancia magnética con gadolinio, corte coronal, que muestra un componente tumoral en la fosa posterior y en la fosa media. Caso ideal para el abordaje petroso (izquierda). Angiografía de fase venosa que muestra drenaje de la vena de Labbé en la unión del sigmoide con el transverso, sin contraindicar el abordaje petroso (centro). Incisión del abordaje petroso (también conocido como abordaje presigmoideo (supra/infratentorial) utilizado en este caso (derecha).
HISTORIA NATURAL Y MANEJO
Por lo general, los meningiomas petroclivales crecen de manera progresiva a diferencia de algunos tumores de la base del cráneo que pueden permanecer estables durante años (schwannomas vestibulares de fondo de meato, microadenoma hipofisario no funcional, meningiomas del seno cavernoso y algunos paragangliomas del foramen yugular). Van Havenberg y sus colegas llevaron a cabo un estudio en el que 21 pacientes con meningiomas petroclivales tratados de forma conservadora fueron objeto de investigación, con un seguimiento mínimo de cuatro años. Los investigadores informaron crecimiento tumoral en el 76% de los casos y empeoramiento clínico en el 63%.[
MATERIAL Y MÉTODOS
Los principales abordajes quirúrgicos utilizados son frontoórbito-cigomático, petroso y retrosigmoideo, los cuales se pueden combinar.[
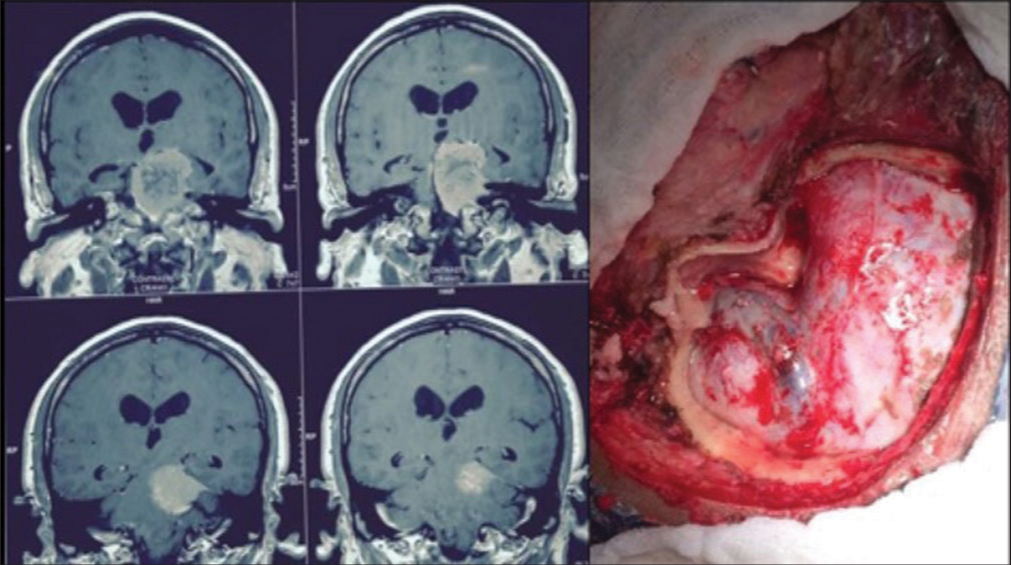
Figura 4:
RM coronal con gadolinio que muestra tumor con componente en la fosa posterior y en la fosa media. Caso ideal para el abordaje petroso, también conocido como petrosectomía posterior o abordaje presigmoideo supra/infratentorial (izquierda). Visualización del abordaje antes de abrir la duramadre (izquierda).
En la petrosectomía total, el procedimiento quirúrgico es inicialmente el mismo que el descrito para el abordaje presigmoideo (o petrosectomía anterior), completado con la extracción adicional de canales semicirculares y cóclea (petrosectomía posterior). La arteria carótida interna petrosa está expuesta a lo largo de su curso dentro del hueso temporal hasta su entrada en el seno cavernoso. Este abordaje es especialmente útil para lesiones muy grandes que cruzan la línea media en pacientes que ya son sordos. Aunque la transposición del nervio facial causará parálisis facial postoperatoria, que mejora dentro de los tres meses posteriores a la cirugía para House-Brackmann grado 1–2, esta maniobra debe evitarse. La trompa auditiva se cierra con músculo para evitar fístula de LCR postoperatoria. Si no hay un espacio corto entre el seno sigmoideo y el laberinto, en pacientes con audición preservada y un seno sigmoideo no dominante, se ha informado un abordaje trans-sigmoideo (referencia). Sin embargo, el concepto de seno sigmoideo no dominante es controvertido y no hay forma de predecir que no ocurrirá un infarto venoso. Una posible solución es hacer un abordaje retrosigmoideo del componente de la fosa posterior en una sola vez y un abordaje pterional y un segundo procedimiento quirúrgico. Ichimura y sus colaboradores utilizaron un abordaje transpetroso anterior en 91 pacientes con meningiomas petroclivales. Indicaron este abordaje especialmente en las lesiones predominantemente de la fosa media, que involucran clivus superior y tentorio, permitiendo el acceso al cavum de Meckel.[
Uno de los abordajes más versátiles para la extirpación de meningiomas petroclivales que no se extienden hacia la fosa media es el abordaje retrosigmoideo [
Figura 5:
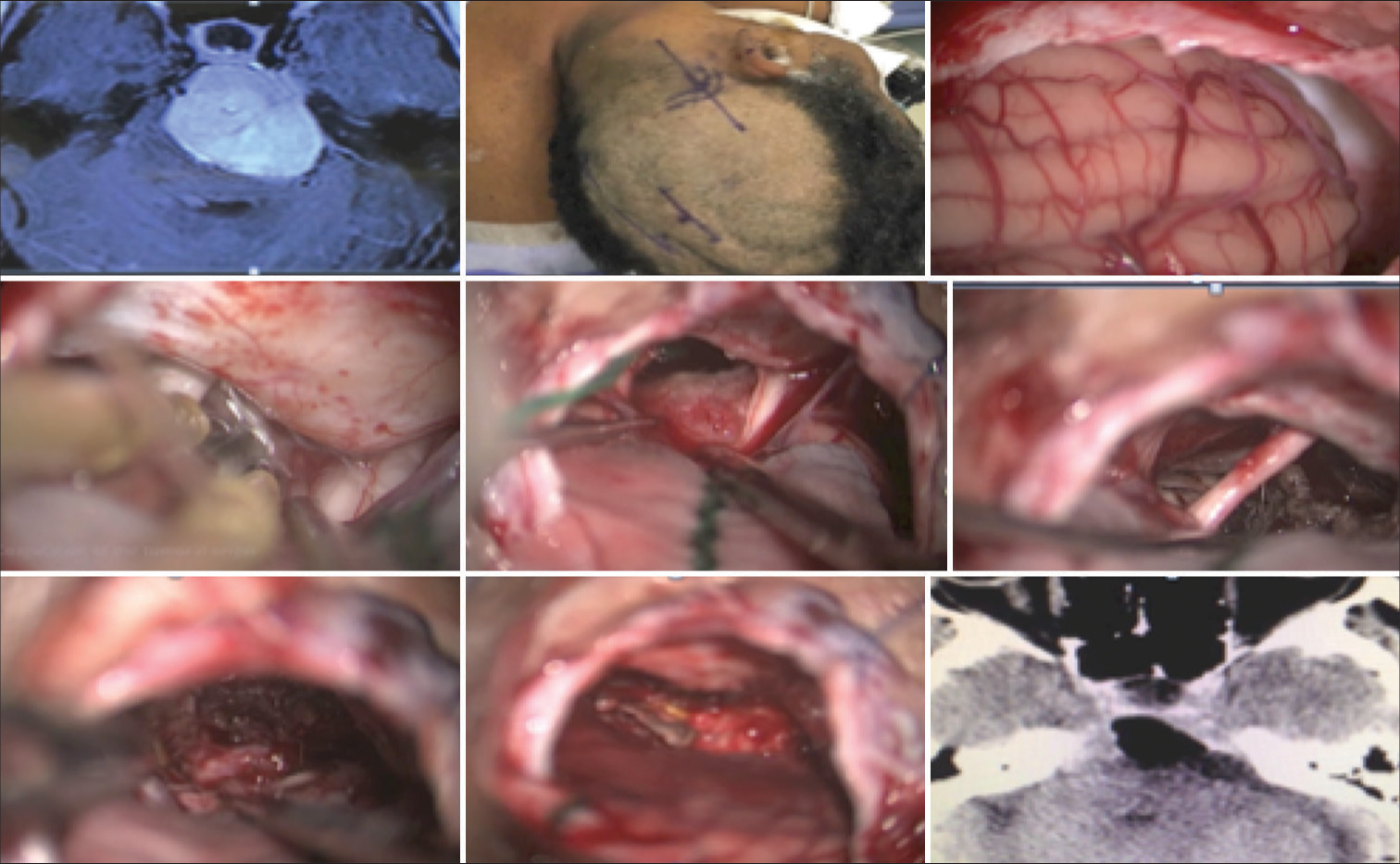
Meningioma petroclival del clivus superior y medio sin extensión de la fosa media. Se seleccionó el abordaje retrosigmoideo para este caso, con el paciente posicionado en decúbito lateral (Park Bench). La craneotomía o craniectomía con reconstrucción con cemento óseo se debe realizar exponiendo parte del seno sigmoideo y transversal. Con eso, la apertura de la duramadre.
Figura 6:
Meningioma petroclival grande resecado por abordaje suboccipital. Se observa un pequeño componente tumoral que se extiende en la fosa media en continuidad con el tentorio. Esta parte tumoral se resecó abriendo el tentorio a través de la fosa posterior. No se resecó una pequeña extensión en el seno cavernoso.
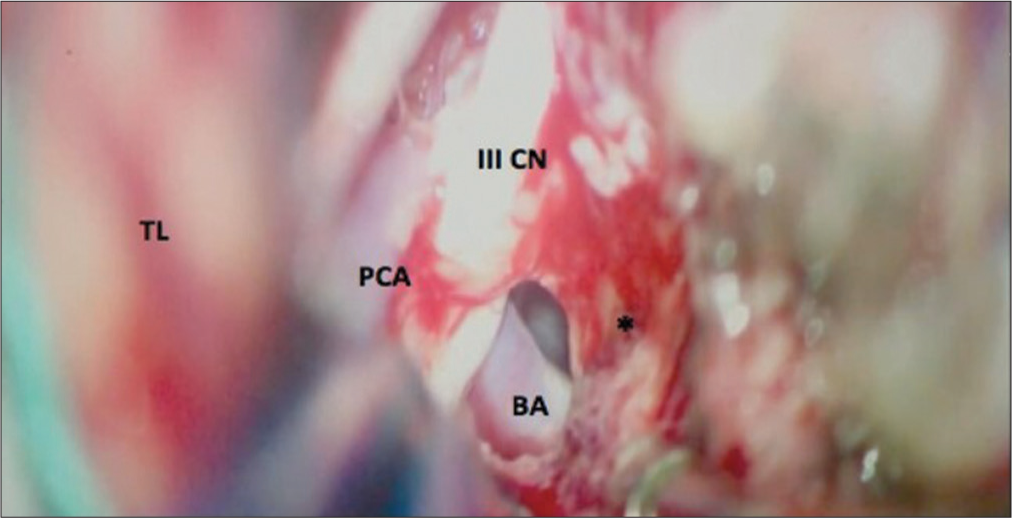
Figura 7:
Imagen intraoperatoria de la Figura 2. Después de la resección del meningioma petroclival, se visualiza el nervio oculomotor (III CN). Arteria basilar (BA) y arteria cerebral posterior (PCA). El lóbulo temporal (TL) está ligeramente retraído. El sitio de implantación del tumor está representado por *.
RESULTADOS
La extirpación total de meningiomas petroclivales se obtiene con mayor frecuencia de pequeñas lesiones. La extirpación subtotal con o sin tratamiento adyuvante generalmente se realiza cuando hay invasión del seno cavernoso. Little y sus colaboradores realizaron una resección subtotal en pacientes con tumores adherentes o fibrosos, lo que redujo significativamente la tasa de déficit neurológico postoperatorio sin aumentar significativamente la tasa de recurrencia tumoral.[
Recientemente, Isolan y sus colaboradores lograron la resección total en la mitad de 22 meningiomas petroclivales operados. En el resto, se realizó resección subtotal y en un caso de meningioma calcificado se realizó resección parcial.
La radioterapia estereotáctica fraccionada y la radiocirugía pueden estar indicadas como tratamiento inicial o adyuvante, especialmente en histologías de meningiomas atípicos y anaplásicos, en casos de crecimiento tumoral después de seis meses.[
Un estudio reciente publicado por Almefty, Dunn y colaboradores informó sobre una serie de 64 pacientes tratados entre 1988 y 2012. Destacaron que la extirpación total (resección de Grado I o II) de meningiomas petroclivales era posible en el 76.4% de los casos y fue facilitado por el uso de abordajes de base cráneo, con buenos resultados y estado funcional. Los autores sugirieron además que, en casos donde las circunstancias impiden la extirpación total, los tumores residuales se pueden seguir hasta que la progresión sea evidente, cuando se puede planificar una nueva intervención.[
DISCUSIÓN
Estas lesiones generalmente requieren diferentes abordajes quirúrgicos y presentan diferentes dificultades quirúrgicas. La elección del abordaje generalmente se basa en la ubicación y extensión del tumor, dependiendo de la participación de las estructuras venosas, como la vena de Labbé, los senos petrosos superior y transverso y la vena petrosa, especialmente en los abordajes petrosos,[
La mayoría de los meningiomas petroclivales son lesiones benignas. La resección total es, en general, el único tratamiento que puede curar a estos pacientes, pero a menudo no es posible debido a la participación e invasión del seno cavernoso, los nervios craneales, los vasos y la piamadre. El tamaño, la consistencia y el comportamiento biológico del tumor son otros factores limitantes. La elección del abordaje quirúrgico y la experiencia del cirujano son muy importantes para lograr buenos resultados. Los tumores pequeños (de hasta tres centímetros de diámetro) generalmente tienen los mejores resultados quirúrgicos.
CONCLUSÍON
El manejo de los meningiomas petroclivales es muy complejo, especialmente porque es una patología rara, debido a la dificultad de acceso y la importancia de las estructuras neurovasculares adyacentes que pueden comprometer. Se pueden utilizar varios abordajes quirúrgicos para la extirpación de estos tumores, cada uno de los cuales presenta ventajas y riesgos. Por lo general, para los tumores ubicados exclusivamente en la fosa posterior, el abordaje retrosigmoideo es suficiente.
Declaration of patient consent
Patients’ consent not required as patients’ identities were not disclosed or compromised.
Financial support and sponsorship
Nil.
Conflicts of interest
There are no conflicts of interest.
Disclaimer
The views and opinions expressed in this article are those of the authors and do not necessarily reflect the official policy or position of the Journal or its management. The information contained in this article should not be considered to be medical advice; patients should consult their own physicians for advice as to their specific medical needs.
References
1. Adams Pérez J, Isolan GR, De Aguiar PH, Antunes AM. Volumetry and analysis of anatomical variants of the anterior portion of the petrous apex outlined by the kawase triangle using computed tomography. J Neurol Surg B Skull Base. 2014. 75: 147-51
2. Almefty R, Dunn IF, Pravdenkova S, Abolfotoh M, Almefty O. True petroclival meningiomas: Results of surgical management. J Neurosurg. 2013. 120: 40-51
3. Bricolo AP, Turazzi S, Talachi A. Microsurgical removal of petroclival meningiomas. A report of 33 patients. Neurosurgery. 1992. 31: 813-28
4. Castellano F, Ruggiero G. Meningiomas of the posterior fossa. Acta Radiol. 1953. 104: 1-177
5. Dini LI, Isolan GR, Flores E, Lombardo EM, Heitz C. Anterior skull base tumors: The role of transfacial approaches in the endoscopic era. J Craniofac Surg. 2018. 29: 226-32
6. Hafez A, Nader R, Al-Mefty O. Preservation of the superior petrosal sinus during the petrosal approach. J Neurosurg. 2011. 114: 1294-8
7. Havenbergh TV, Carvalho G, Tatagiba M, Plets C, Samii M. Natural history of petroclival meningiomas. Neurosurgery. 2003. 52: 55-64
8. Ichimura S, Kawase T, Onozuka S, Yoshida K, Ohira T. Four subtypes of petroclival meningiomas: Differences in symptoms and operative findings using the anterior transpetrosal approach. Acta Neurochir (Wien). 2008. 150: 637-45
9. Isolan GR, De Oliveira E, Mattos JP. Microsurgical anatomy of the arterial compartment of the cavernous sinus: Analysis of 24 cavernous sinus. Arq Neuropsiquiatr. 2005. 63: 259-64
10. Isolan GR, Krayenbühl N, De Oliveira E, Al-Mefty O. Microsurgical anatomy of the cavernous sinus: Measurements of the triangles in and around it. Skull Base. 2007. 17: 357-67
11. Isolan GR, Wayhs SY, Lepski GA, Dini LI, Lavinsky J. Petroclival meningiomas: Factors determining the choice of approach. J Neurol Surg B Skull Base. 2018. 79: 367-78
12. Jung HW, Yoo H, Paek SH, Choi KS. Long term outcome and growth rate of subtotally resected petroclival meningiomas. Experience with 38 cases. Neurosurgery. 2000. 46: 567-75
13. Kaku S, Miyahara K, Fujitsu K, Okada T, Ichikawa T, Abe T. Drainage pathway of the superior petrosal vein evaluated by CT venography in petroclival meningioma surgery. J Neurol Surg B. 2012. 73: 316-20
14. Krayenbühl N, Isolan GR, Al-Mefty O. The foramen spinosum: A landmark in middle fossa surgery. Neurosurg Rev. 2008. 31: 397-401 discussion 401-2
15. Kumar S, Kakkar A, Suri V, Kumar A, Bhagat U, Sharma MC. Evaluation of 1p and 14q status, MIB-1 labeling index and progesterone receptor immunoexpression in meningiomas: Adjuncts to histopathological grading and predictors of aggressive behavior. Neurol India. 2014. 62: 376-82
16. Little KM, Friedmann AH, Sampson JH, Wanibuchi M, Fukushima T. Surgical management of petroclival meningiomas: Defining resection goals based on risk of neurological morbidity and tumor recurrence rates in 137 patients. Neurosurgery. 2005. 56: 546-59
17. Lombardi IS, editors. Avaliação do Perfil de Expressão Gênica em Meningiomas Pela Técnica de NANOSTRING. Tese (Doutorado em Bases Gerais da Cirurgia). Botucatu: Faculdade de Medicina, Universidade Estadual Paulista; 2017. p.
18. Maurer AJ. Management of petroclival meningiomas: A review of the development of current therapy. J Neurol Surg B Skull Base. 2014. 75: 358-67
19. Mayberg MR, Symon L. Meningiomas of the clivus and apical petrous bone: Report of 35 cases. J Neurosurg. 1986. 65: 160-7
20. Nanda A, Javalkar V, Banerjee AD. Petroclival meningiomas: Study on outcomes, complications and recurrence rates. J Neurosurg. 2011. 114: 1268-77
21. Ohba S, Yoshida K, Hirose Y, Ikeda E, Kawase T. Early malignant transformation of a petroclival meningothelial meningioma. Neurosurg Rev. 2009. 32: 495-9
22. Ramina R, Fernandes YB, Neto MC, Aguiar PH, Tatagiba M, editors. Petroclival meningiomas: Diagnosis, treatment, and results. Samii’s Essentials in Neurosurgery. Berlin, Heidelberg: Springer-Verlag; 2008. p. 121-35
23. Roser F, Samii M, Ostertag H, Bellinzona M. The Ki-67 proliferation antigen in meningiomas. Experience in 600 cases. Acta Neurochir (Wien). 2004. 146: 37-44 discussion 44
24. Samii M, Tatagiba M, Carvalho GA. Retrosigmoid intradural suprameatal approach to Meckel’s cave and the middle fossa: Surgical technique and outcome. J Neurosurg. 2000. 92: 235-41
25. Santos FP, Longo MG, May GG, Isolan GR. Computed tomography evaluation of the correspondence between the arcuate eminence and the superior semicircular canal. World Neurosurg. 2018. 111: e261-6
26. Sekhar LN, Fessler RG, editors. Atlas of Neurosurgical Techniques. New York: Thieme; 2006. p.
27. Starke RM, Williams BJ, Hiles C, Nguyen JH, Elsharkawy MY, Sheehan JP. Gamma knife surgery for skull base meningiomas. J Neurosurg. 2012. 116: 588-97
28. Wayhs SY, Lepski GA, Frighetto L, Isolan GR. Petroclival meningiomas: Remaining controversies in light of minimally invasive approaches. Clin Neurol Neurosurg. 2017. 152: 68-75
29. Yasargil M, Mortara R, Curcic M. Meningiomas of basal posterior cranial fossa. Adv Tech Stand Neurosurg. 1980. 7: 3-115
30. Yasargil MG, editors. Microneurosurgery IV A: CNS Tumors: Surgical Anatomy, Neuropathology, Neuroradiology, Neurophysiology, Clinical Considerations, Operability, Treatment Options. Stuttgart: Thieme; 1994. p.
31. Yasargil MG, editors. Microneurosurgery IV B: Microneurosurgery of CNS Tumors. Stuttgart: Thieme; 1996. p.